Osmolaridade e Tonicidade
18.25k views2034 WordsCopy TextShare

Monitoria em Fisiologia e Biofísica ICB-UFMG
Video Transcript:
Esse vídeo é uma iniciativa do departamento de fisiologia e biofísica do ICB da UFMG Você conhece a osmolaridade? E a tonicidade? Nesse tópico vamos abordar suas definições e situações problema que as envolvem Para isso teremos que entender também os processos de difusão e osmose.
Vamos lá? O que é a osmolaridade? Para responder a essa pergunta, precisamos relembrar os conceitos abordados no módulo 1 da aula de soluções A osmolaridade nada mais é do que outra forma de expressar a concentração Bem como a molaridade, que expressa a quantidade em mol de soluto em 1 litro de solução, ou 1000 mL de solução E o percentual que expressa a quantidade em gramas de soluto em 100 mL de solução A osmolaridade expressa a quantidade em osmol de soluto em 1 L de solução, ou 1000 mL de solução Mas o que seria esse tal de osmol?
Nada mais nada menos do que a medida de mol de partículas dissociadas Sabemos que em meio aquoso, compostos iônicos como cloreto de sódio se dissociam Isso significa que em água, nunca se encontra o composto NaCl, mas sim suas formas iônicas separadas, ou seja, dissociadas O cátion Na+ e o ânion Cl- Se essa solução possui concentração molar igual a 0,1 mol/L, podemos concluir que sua concentração osmolar é igual a 0,2 osm/L Já que o NaCl se dissocia em duas partículas, então basta multiplicar a concentração molar por este número Agora pensem: qual a concentração osmolar de uma solução de CaCl2 (cloreto de cálcio), cuja molaridade é igual a 0,2 mol/L Se sua resposta foi igual a 0,4 osm/L, cuidado! Você caiu na pegadinha Lembre-se de pensar no balanceamento da equação CaCl2 se dissocia em uma partícula de Ca2+ e duas de Cl-, ou seja, são três partículas dissociadas e não duas Então a resposta correta seria 0,6 osm/L Já no caso de compostos que não se dissociam, como por exemplo a ureia, a concentração molar é sempre igual a osmolar, mudando apenas a unidade de medida de mol/L para osm/L Então se temos uma solução de 1 mol/L de ureia, sua concentração osmolar também será de 1 (só que osm/L) Agora vamos relembrar, o que é difusão? A difusão é responsável pelo movimento de soluto de um meio mais concentrado para outro menos concentrado Mas o que essa frase que tanto vemos em aulas de química e tanto nos esforçamos para decorar de fato significa?
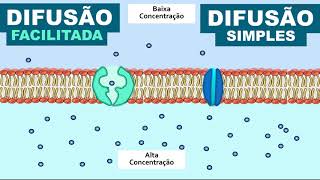
Obviamente, o soluto não pensa: "Estou em um meio mais concentrado, preciso me mover até um menos concentrado" A difusão é um movimento espontâneo completamente aleatório O soluto pode até não pensar, mas ele possui energia térmica, que é convertida em energia cinética, ou seja, ele se movimenta Quando há moléculas de soluto juntas, todas se movimentando, elas tenderão a colidir umas com as outras e com as moléculas de solvente que estão no meio até se espalharem E assim ocorre o famoso deslocamento do meio mais concentrado para o menos concentrado até que as concentrações de ambos os meios se igualem Ou seja, a difusão nada mais é do que o movimento térmico aleatório que por probabilidade desencadeará o espalhamento de matéria É isso que significa o tal movimento de soluto do meio mais concentrado para o menos concentrado Agora que você aprendeu, não precisa mais ficar decorando! Agora vamos falar de osmose? A osmose nada mais é do que o movimento de água por difusão E como o transporte por difusão é gerado pela diferença de concentração, precisamos nos perguntar o que determina a concentração da água em solução aquosa Quanto maior for a concentração de solutos, menor será a concentração de água por causa do volume ocupado pelo soluto na solução e vice-versa Dessa forma, a osmolaridade, que mede a concentração molar de todas as espécies dissolvidas na solução Se torna uma ferramenta poderosa para comparar a concentração de água entre diferentes meios, e prever seu movimento através de uma membrana Mas, como explicaremos a seguir, o transporte de água através de uma membrana não depende apenas da diferença de osmolaridade Depende também da permeabilidade da membrana aos solutos E se você já assistiu nossa aula sobre membranas, deve saber que as membranas celulares são seletivas, ou seja, elas ajustam a permeabilidade das substâncias Sendo que há moléculas permeáveis e não permeáveis em diferentes fases celulares O coeficiente de reflexão é a variável quantitativa que define o grau de permeabilidade do soluto à membrana Ele possui valores de 0 a 1 que variam de acordo com o soluto Sendo que soluto que possuem o coeficiente igual a 0 não são refletidos, ou seja, atravessam 100% a membrana Enquanto os que possuem coeficiente igual a 1 são completamente refletidos, ou seja, não atravessam a membrana Contudo, o coeficiente também pode assumir valores intermediários, por exemplo Por exemplo, imagine o soluto cujo coeficiente de reflexão é igual a 0,5.
Apenas metade das suas partículas serão capazes de atravessar a membrana enquanto a outra metade será refletida Vamos ilustrar e deixar mais claros esses conceitos através de alguns exemplos Exemplo 1: Uma membrana impermeável a todos os solutos, ou semipermeável, separa os meios 1 e 2, sendo que o meio 1 tem maior osmolaridade que o meio 2 Então falamos que o meio 1 é hiperosmolar em relação ao meio 2 Em qual direção a água será transportada? A água, por ser mais concentrada no meio 2 que no meio 1, irá se difundir de 2 para 1 Fácil né? Agora vamos ao segundo exemplo Uma membrana separa o meio 1, contendo o soluto 1 e o meio 2, contendo o soluto 2, sendo permeável ao soluto 1 e impermeável ao soluto 2 Assumimos que, inicialmente, os meios 1 e 2 apresentam a mesma osmolaridade, e portanto são isosmolares Haverá transporte de água, se sim, em qual direção?
Como o soluto 1 é permeável e é mais concentrado no meio 1 do que no meio 2, ele se deslocará por difusão do meio 1 para o meio 2 Resultando na diminuição da osmolaridade do meio 1, e no aumento da osmolaridade do meio 2 Dessa forma, gera-se diferença de osmolaridade entre os meios 1 e 2, o que provoca o transporte do meio hiposmolar (meio 1) para o meio hiperosmolar (meio 2) Esses dois exemplos ilustram que a osmose é determinada tanto pela diferença de osmolaridade através da membrana, quanto pela permeabilidade da membrana ao soluto Como vimos também, apenas a comparação de osmolaridade inicial não permite prever o movimento de água Para facilitar a previsão do fenômeno de osmose, introduz-se o conceito de tonicidade A tonicidade de uma solução corresponde à pressão exercida pelo seu soluto sobre a membrana, também conhecida como pressão osmótica Sendo que apenas os solutos impermeáveis ou pouco permeáveis exercem pressão sobre a membrana, e portanto contribuem para a pressão osmótica Os solutos permeáveis que não contribuem para a pressão osmótica são ditos como osmoticamente inativos A pressão osmótica se relaciona à osmolaridade dos solutos impermeáveis conforme a lei de Van't Hoff Aonde R é a constante dos gases perfeitos, e T é a temperatura em Kelvin Quando estuda-se o transporte de água entre dois compartimentos separados por uma membrana, compara-se a pressão osmótica entre os dois compartimentos Falamos que o meio com maior pressão osmótica é hipertônico, e aquele com menor pressão osmótica é hipotônico Sendo que a água se difunde sempre do meio hipotônico para o hipertônico, no sentido de igualar as pressões e torná-las isotônicas Agora vamos aplicar esses conceitos a um sistema celular, considerando dois solutos: a ureia e o NaCl A ureia é uma molécula capaz de permear a membrana pois atravessa canais de água chamados de aquaporinas Isso significa que ela não exerce força na membrana, já que a atravessa livremente Então, podemos concluir que a ureia, bem como todas as outras substâncias permeáveis a membrana como a água, não contribuem para a tonicidade Por outro lado, os íons de Na+ que estão mais presentes no exterior da célula tendem a entrar na célula por difusão, mas são barrados pela membrana seletiva Assim, podemos dizer que os íons Na+ e todas as outras substâncias impermeáveis à membrana estarão pressionando a membrana por meio da força de difusão e dessa forma estarão contribuindo para a tonicidade Aqui temos uma situação problema Uma gota de sangue é colocada em uma solução contendo ureia 300 mM e NaCl 150 mM Considerando que a concentração intracelular da hemácia é padronizada como 300 mOsm, classifique o meio extracelular de acordo com a tonicidade e concentração osmolar O meio extracelular é hiperosmolar, pois possui concentração de 600mOsm. Enquanto a do intracelular é 300mOsm Porém ele é isotônico, já que como a célula é permeável a ureia, ela não exerce tonicidade, e portanto é desconsiderada do cálculo O novo cálculo fica assim: 300mOsm do meio intracelular, e também do meio extracelular, ou seja, isotônico Temos agora uma última situação problema Uma gota de sangue é colocada em uma solução de ureia a 300 mOsm. Qual é a concentração osmolar de ureia dentro e fora da hemácia?
Como você pode perceber, tal questão é uma pegadinha. Para resolvê-la, você tem que pensar na relação de volume de uma hemácia Sabendo que uma pessoa saudável possui um hematócrito de 0,5, e que uma gota de sangue possui aproximadamente 50 microlitros Podemos concluir que o volume ocupado por hemácias nessa gota é a metade, ou seja, 25 microlitros Ou então 0,025 mL, ou 0,000025 litros Ou seja, as hemácias presentes em uma gota de sangue ocupam um volume muito pequeno Por isso, haverá um deslocamento mínimo de soluto, pois é necessária uma massa também muito pequena de ureia para entrar na hemácia e igualar as concentrações, já que o volume é desprezível Então podemos dizer que as concentrações de ureia dentro e fora da hemácia são de aproximadamente 300 mOsm, Pois como houve deslocamento de massa muito pequeno, a concentração extracelular praticamente não se alterou, enquanto a concentração intracelular logo atingiu o mesmo valor da extracelular Se você ainda não está satisfeito com a aproximação, é só comprovar com a fórmula que você aprendeu na aula de soluções, no módulo 1 C1 . V1 = C2 .
V2 Temos C1 igual a concentração da solução de ureia, que é igual a 300 mOsm/L V1, que é o volume da solução de ureia, que não foi dado na questão, mas vamos supor que seja 10mL, que é um valor bem aplicado ao cotidiano E C2, a concentração final, que será igual para ambos os meios, pois eles se tornarão isotônicos E V2, que é o volume total, que é o intracelular mais o extracelular Aplicando, temos que: 300 mOsm x 10mL é igual a C2 x 10,025mL C2 dá: 299,251870324 mOsm, ou seja, uma aproximação para 300 mOsm Você pode estar pensando, mas se o volume da solução de ureia for menor, poderemos ter uma redução significante da concentração, não podendo mais aproximá-la para 300mOsm Mas a verdade é que você pode realizar tal conta com qualquer volume cotidianamente aplicável, ou seja, que faça sentido para uma solução E você obterá a mesma aproximação para 300 mOsm. Quer ver? Vamos pegar um volume de 5mL A conta fica assim: 300 mOsm x 5mL = C2 x 5,025mL C2 dá 298,507462687 mOsm, que também é um valor muito próximo de 300 mOsm e podemos aproximar para esse valor Já está convencido agora né?
Então vamos para a próxima parte Vamos falar da importância biológica do que aprendemos até agora Os meios isotônicos são ideais para o funcionamento das células, pois eles mantém o volume interior constante Já que o movimento de solvente se dá de forma igual, a quantidade de água que entra é a mesma que sai, mantendo o volume Isso não ocorre com meios hipertônicos, os quais por serem mais concentrados, retirarão a água de dentro das células, murchando-as E nem com os hipotônicos, que por serem menos concentrados do que a célula, desencadearão movimento de água para dentro dela, inchando-a Ambas essas condições podem causar lise e morte celular O conteúdo de hoje é esse.
Related Videos
9:28
Transporte pela Membrana - Difusão e Osmose
Gabriel Moraes
64,775 views

4:37
Vídeo curto - Difusão e Osmose
Monitoria em Fisiologia e Biofísica ICB-UFMG
12,680 views

2:23
Vídeo curto - Osmolaridade
Monitoria em Fisiologia e Biofísica ICB-UFMG
26,601 views
![[#2] OSMOSE: MOLARIDADE, OSMOLARIDADE E TONICIDADE | MK Fisiologia](https://img.youtube.com/vi/i8WhhHEMWJI/mqdefault.jpg)
17:38
[#2] OSMOSE: MOLARIDADE, OSMOLARIDADE E TO...
MK Fisiologia
3,966 views

9:12
Potencial de Membrana
Monitoria em Fisiologia e Biofísica ICB-UFMG
54,398 views

40:05
ÁLCOOL: existe DOSE SEGURA para consumo de...
Dr. Samuel Dalle Laste
4,672,259 views

10:34
Compartimentalização dos Líquidos Corporais
Monitoria em Fisiologia e Biofísica ICB-UFMG
7,109 views

37:07
Biofísica da difusão, osmose e tônus
Kemile Leão (Prof. Kem Leão)
3,208 views

9:20
OSMOSE: meio isotônico, hipotônico e hiper...
Curso Enem Gratuito
60,397 views

10:13
Sistemas sensoriais químicos - Gustativo
Monitoria em Fisiologia e Biofísica ICB-UFMG
23,695 views

12:32
POTENCIAL DE AÇÃO
Monitoria em Fisiologia e Biofísica ICB-UFMG
16,443 views

14:31
Transporte através da membrana - Fisiologi...
Fisiologia Humana
38,918 views

8:20
SOLUÇÃO: Soluto e Solvente - Hipertônica |...
Biologia com Samuel Cunha
199,298 views

14:17
O QUE É OSMOSE
Biologia de Verdade
45,622 views
![[#1] OSMOSE: O QUE É OSMOSE? | MK Fisiologia](https://img.youtube.com/vi/NWMMLX_sKKE/mqdefault.jpg)
8:02
[#1] OSMOSE: O QUE É OSMOSE? | MK Fisiologia
MK Fisiologia
4,756 views

13:54
TRANSPORTE PASSIVO: Difusão Simples | Difu...
Biologia com Samuel Cunha
605,718 views

6:44
RESUMO sobre MEMBRANA PLASMÁTICA | Biolog...
Biologia com Samuel Cunha
25,908 views

14:16
OSMOSE NA CÉLULA ANIMAL - Transporte Passi...
Paulo Jubilut
341,843 views

14:24
OSMOSE E SEUS MECANISMOS - BIOLOGIA MOLECU...
Facilitando a Medicina
3,684 views

12:57
Fisiologia: Aula 2 - Fisiologia celular - ...
EscolaCVI
279,106 views