Química: Ligações Covalentes Polares e Apolares
903.55k views830 WordsCopy TextShare
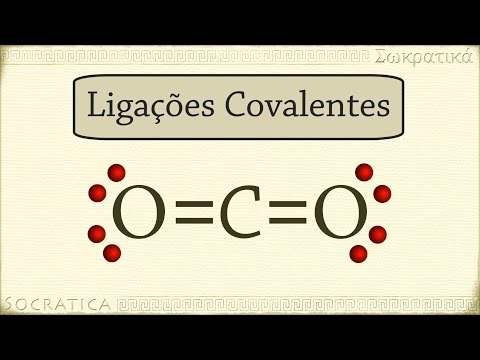
Socratica Português
LIgações covalentes são um dos três tipos principais de forças intramoleculares junto com ligações i...
Video Transcript:
as forças que mantém os átomos unidos formando moléculas ou compostos são chamadas de forças entre moleculares os três tipos principais de forças entre moleculares são as ligações e únicas ligações covalentes ligações metálicas esse vídeo vai se concentrar nas ligações covalentes ligações e únicas e metálicas terão seus próprios vídeos e ligações covalentes são estáveis porque os átomos de ligação chegou a configurações de gás nobre ao dividirem elétrons o nome com valente deveria sugerir a quem ler que os átomos estão dividindo seus elétrons valencia podemos mostrar isso com o diagrama de pontos de lewis o ácido fluorídrico
hf é uma molécula com uma única ligação covalente formada entre dois átomos o flu tem sete elétrons valência e o hidrogênio tem 11 por dividir em dois elétrons em uma ligação o hidrogênio agora tem dois elétrons de valência e tem a mesma configuração de elétrons que o gás nobre hélio o flu agora tem oito elétrons valência e tem a mesma configuração de elétrons que o gás nobre neon podemos colocar os dois elétrons compartilhados como uma linha no diagrama representando assim a única ligação covalente às vezes dois átomos de vida em mais de dois elétricos no
caso de ligações covalentes duplas ou triplas podemos ver um exemplo disso no dioxxy de carbono co2 a estrutura de lewis fica assim o carbono tem quatro elétrons valência e oxigênio 6 o carbono precisa de mais quatro elétrons para chegar ao estado de gás nobre o oxigênio precisa de mais dois para atingir o mesmo estado isso pode acontecer se o átomo de carbono formar duas ligações duplas com cada átomo de oxigênio podemos colocar as duas duplas de elétrons compartilhados no diagrama como duas linhas representando assim a ligação dupla se os dois átomos numa ligação covalente foram
idênticos terão a mesma eletronegatividade a ligação entre esses atos idênticos é chamada de ligação covalente apolar o hidrogênio por exemplo existe na natureza com uma molécula de atômica h2 os dois átomos de hidrogênio puxa igualmente no par de elétrons divididos na ligação portanto não há nenhuma direcionalidade ou colar idade na ligação compare isso com as ligações de uma molécula pular com uma água h2o oxigênio mais eletronegativa o hidrogênio portanto os elétrons nas ligações covalentes passou mais tempo ao redor do oxigênio do que do hidrogênio chamamos esse tipo de compartilhamento desigual de elétrons de ligação covalente
polar perceba que isso resulta na molécula de água como um todo sendo polar um lado da molécula é mais negativo do que o outro usamos delta para ilustrar a carga parcial negativa do átomo de oxigênio ea carga parcial positiva dos átomos de hidrogênio usamos delta para distinguir essas cargas parciais das cargas completas 12 anos é possível de confundir com mulher com os que contém ligações covalentes polares e moléculas inteiramente polares a água é os dois contém ligações covalentes polares e é uma mulher com o colar como um todo porque um lado da molécula é levemente
positivo e outro gravemente negativo esse resultado se deve às ligações covalentes polares que mantém a molécula da água unida consideremos o tetra cloreto de carbono ccl 4 o cloro é mais eletronegativa o carbono então essa molécula tem quatro ligações covalentes polares podemos pensar que o adicionarmos quatro ligações essa molécula se tornará extremamente popular como resultado mas na verdade quando olhamos para a estrutura tridimensional vemos que as quatro ligações apontam em quatro direções diferentes e acabam se cancelando entre si não se pode achar um lado do ccl 4 que seja mais positivo ou negativo que o
outro portanto o tetra cloreto de carbono como um todo é uma molécula apolar químico geralmente medem a polaridade de uma ligação de acordo com uma escala estabelecida por linus pauling se eletronegatividade relativa dos átomos ligação difere por menos de 0,4 na escala de paulin a ligação é considerada covalente apolar se a diferença na eletronegatividade for entre 0,4 e 1,7 a chamamos de ligação covalente polar se eletronegatividade se estiverem a mais de 1,7 então é uma ligação e única será que as liga escovar lentes assim como muitas ligações e únicas são desestruturadas pela água algumas sim
outras não a sacarose c 12h 2020 11 ou açúcar de mesa por exemplo é uma molécula com átomos ligados através de ligações covalentes se colocarmos a sacarose ou outros açúcares em água as ligações covalentes permanecem intactas ea solução de água e açúcar não conduz eletricidade tão bem quanto à solução de água e sal por sua vez os ácidos como ácido clorídrico hcl são compostos covalentes que rapidamente sofrem dissociação transformando-se em h positivo e cl negativo portanto eles conduzem eletricidade chamamos essas substâncias que se unirão quando dissolvidas de eletrólitos a maioria dos sites solúveis ácidos bases
se comportam dessa maneira apesar de algumas ligações covalentes se dissolverem água elas são consideradas ligações fortes assim como as ligações e únicas compararemos suas forças relativas em outro vídeo
Related Videos

7:54
Tabela Periódica
Socratica Português
925,223 views

12:02
🧪 LIGAÇÃO IÔNICA E COVALENTE
Professor Gabriel Cabral
98,775 views

17:36
Polaridade de Ligações | Ligações Químicas
Professor Igor Química
35,749 views

11:17
London Dispersion Forces & Temporary Dipol...
The Organic Chemistry Tutor
380,030 views

Classical Piano & Fireplace 24/7 - Mozart,...
Odd Eagle

9:38
LIGAÇÕES COVALENTES | Resumo de Química pa...
Curso Enem Gratuito
40,566 views

8:49
South Korean president declares emergency ...
CNN
1,202,833 views

22:45
Beat Ronaldo, Win $1,000,000
MrBeast
93,919,194 views

5:29
Desvendando a GEOMETRIA MOLECULAR: O que é...
Toda Matéria
81,323 views

7:44
South Korea's parliament votes to block ma...
BBC News
390,800 views
![Polaridade das Moléculas [Prof. Gabriel Cabral]](https://img.youtube.com/vi/S-QAgrLI3dw/mqdefault.jpg)
17:30
Polaridade das Moléculas [Prof. Gabriel Ca...
Professor Gabriel Cabral
478,124 views

20:29
Resumo Ligações Químicas: TUDO O QUE VOCÊ ...
KiFacil
100,833 views

9:10
Ligações químicas: tipos e características
Toda Matéria
1,065,098 views

6:37
🧪 LIGAÇÃO COVALENTE POLAR E APOLAR
Professor Gabriel Cabral
13,741 views

4:50
Química: Ligações Iônicas
Socratica Português
296,396 views

24:43
LIGAÇÕES QUÍMICAS | REGRA DO OCTETO | IÔNI...
Professor Igor Química
910,860 views

9:18
POLARIDADE DAS MOLECULAS
Professor Gabriel Cabral
14,225 views

16:13
POLARIDADE DAS MOLÉCULAS
QUÍMICA DO MONSTRO
331,095 views

9:25
Entenda a TABELA PERIÓDICA em 10 minutos -...
Toda Matéria
1,809,223 views

4:11
Química: Metais e Ligações Metálicas
Socratica Português
294,133 views