HIBRIDAÇÃO DO CARBONO - COMPLETÃO (MÉDIO E SUPERIOR)
248.69k views5678 WordsCopy TextShare

QUÍMICA DO MONSTRO
FAAAALA, GALERA!!! No vídeo de hoje, o MONSTRÃO vai cair dentro da hibridação, também conhecida como...
Video Transcript:
o ney tá gravando e oi fala galera por aqui professor marco zenni o mostrando a química e esse é o química do monstro [Música] fala galera na aula de hoje nós vamos falar sobre hibridização com o hibridação do átomo de carbono quais são as civilizações que você já conhece é isso aqui é manjada se o cara questão de vestibular que cai com a batida na cadeia carbônica e perguntar quantos carbonos sp2 ele na cadeia carbônica cujos cargos sp2 você tem na cadeia carbônica então isso é fácil para caramba se liga só nós temos três tipos
de habilitação para o átomo de carbono beleza temos várias outras civilizações mas aqui só nos interessa uma do carbono eu tenho o carbono hibridizado sp3 sp2 que o carbono hibridizado sp nós temos 4 possibilidades de ligação por carbono e três tipos de indenização se liga primeiro o carbono hibridizado sp3 é um carbono que faz 4 ligações simples um carbono tetraédrico que faz apenas ligações sigma esse símbolo zinho aqui que significa cima tudo bem beleza então são quatro ligações do tipo sim já o carbono sp2 é o carbono que faz uma dupla e duas ligações simples
então ele faz três ligações sigmas todas as ligações aquelas sigma sigma sigma e uma ligação do tipo pe a ligação sigma nós vamos chamar de interação axial ea ligação pi interação paralela a ligação sigma já já vou explicar o porquê disse para vocês e o carbono hibridizado sp eo carbono que faz duas ligações cílios e dos ligações então aqui ó essas duas aqui cima esse dima a pe a de cima dias eu podia ser signo em cima aqui embaixo tranquilo tanto faz por causa da dupla agora quando tem uma simples e uma tripla negócio muda
quando tem o carbono por ligação simples e uma triplo as cincos é sério na tv por quê que você tá acostumado a ver acima piperan beleza tá errado na verdade a rigor acima seria essa ligação do meio à pizzaria essa de cima e ap essa de baixo então nós temos duas ligações do tipo pi e duas ligações do tipo cima esse é o carbono sp geometria deste carbono o carbono sp3 e não carbono tetraédrico o carbono sp2 é um carbono trigonal o plano ou somente tribunal e o carbono sp é um carbono de geometria e
linear trigonal tetraédrico show de bola hein e nós estamos três realizações diferentes só para o átomo de carbono e aí porque que o carbono hibridizado sp3 tem quatro ligações sigmas o que é uma ligação signo tudo isso eu vou responder já já volta um ponto rapidinho para você tirar o seu pente aqui perguntou beleza vamos ver então como é que funciona essa hibridização na verdade a indenização galera é uma rearranja eletrônico que o átomo de carbono faz para poder em vez de duas ligações de acordo com a teoria de ligação de valência ele poder realizar
quatro ligações partiu e aí o que é civilização o que que acontece na verdade pessoal a gente vai ter que ter um olhar um pouquinho mais cântico aqui da situação abandonar esse modelo determinístico de átomo só a por enquanto em parte por um modelo probabilístico aquele que fala da mecânica quântica densidade de probabilidade os hospitais atômicos se combinando nas combinações lineares digitais atômicos são as cores formando os orbitais moleculares enfim a falar sobre teoria de ligação de valência que que essa teoria até retificação de valência diz que para os átomos se ligarem eles precisam fazer
uma sobreposição de orbitais atômicos transformou nesse hospitais vantagem moleculares eu só posso fazer ligações com elétrons desemparelhados o que são esses elétrons desemparelhados são pares de elétrons que não estão completos ou seja são pares de elétrons são elétrons sozinhos tudo bem você liga para entendermos isso se liga na distribuição eletrônica que eu vou fazer aqui distribuição eletrônica em nossa cs distribuição eletrônica em ordem crescente de energia dos subníveis do ato beleza então eu tenho que o átomo de carbono com o número de 6 elétrons e aí nos ordem crescente de energia dos subníveis fica assim
ó subnível s camada 12 elétrons no subnível s camara 22 elétrons no subnível p câmara 22 elétrons lembra dos subníveis s p d f no subnível s cabem até dois elétrons no p cabe até 6 elétrons no bk bem até 10 elétrons e no skb fala galera beleza então no subnível s da camada um eu tenho dois elétrons no essa da camada dois tem dois e no pé da camada dois também tenho dois elétrons qual é a camada que o interessa a segunda que tem subnível s e p por quê porque era minha camada de
valência botar aqui no cerveja e camada de valência show de bola beleza então essa câmera de ar está representado assim lembra que o subnível s você representa por um quadradinho e o subnível o tempo três quadradinhos um quadradinho para cada dois elétrons na verdade sua representação meramente didática só para facilitar a nossa nossa língua é um quadradinho só não claro que não a gente a partir para outro princípio qual seria a representação do subnível s só que eu representação de idade só pra gente fazer distribuição eletrônica então não é se da câmara dois eu tenho
dois elétrons esses dois estão emparelhados com os peso aposte no subnível p eu tenho dois e aí pela regra de randy o princípio da exclusão de pauli você tem que primeiro colocar os elétrons e por quê porque isso vai ser a configuração é essa vai ser a configuração de memória energia beleza primeiro você distribuir e depois você vem fazendo o emparelhamento ou seja energia de emparelhamento vai ser associada depois então primeiro você distribuir depois você em parelha beleza então tem aqui dois elétrons desemparelhados opa então tem um par de elétrons aqui emparelhado e dois elétrons
desemparelhados teoricamente pela teoria de ligação de valência nós temos aqui um espaço dois espaços por carbono fazer ligação então carbono pela tlv seria tele ver teoria de ligação de valência o carbono seria divalent então eu só poderia fazer duas ligações é isso que a gente percebe natureza não na natureza mas achamos o carbono fazendo sempre quatro ligações seja 4 simples é duas duplas e uma atriz ou uma simples tripla é ou então uma dupla e dos ligações simples e essas quatro possibilidade sempre com carbono fazendo quatro ligações 4 simples uma duplo e 2 simples duas
duplas ou uma simples e uma triplo então essas são as possibilidades caraca como é que atende ligação de valença fala que ele só faz dois porque isso pode ser explicado pela hibridização hibridização na verdade é um arranjo eletrônico que o átomo de carbono faz para poder fazer com que haja a possibilidade da realização dessas quatro ligações assim ó nós vamos começar seguinte vamos entender com a representação que eu tô usando aqui aqui eu estou usando ordem crescente de energia dos subníveis contam quanto mais à direita nessa distribuição maior a região sul mineiro então fiz assim
ó eu tenho um eixo aqui de energia quanto mais pra cima maior energia tudo bem beleza e eu começo com o estado inicial esse primeiro estado aqui esse primeiro momento que eu vou estar aqui em verde vai ser nosso estado é fundamental o ou seja o estado original do átomo de carbono beleza no estado fundamental nós temos essa configuração aqui o subnível s da camada dois com dois elétrons e um pouco acima com um pouco mais energia o subnível p com dois elétrons botei aqui um px e outro no peito a mim podia ser um
px eu não pensei sim porque esses três hospitais aqui são habitar espeto degenerados ou seja degenerado significa que os três tem a mesma energia tranquilo beleza então o que que vai acontecer eu vou fazer o seguinte eu vou fazer com que esse elétron daqui passe para cá e puxa marquinhos mas vou precisar dar uma energia para esse elétron sim ele precisa ganhar uma energia para que para que haja uma inversão seu spin e para que ele possa ir para um subnível mais energético então nós vamos para um novo estado de maior energia daqui ó vou
puxar uma certa para cima e nós vamos pouquinho menos inclinado e nós vamos um estado de maior energia puxa essa para cima estado de uma alergia eu vou ter o subnível 2s mais energético subiu energia dois e o mais energético lindo os peixinhos pytz 2p e eu tenho que ir px pipo e o top ver qual é a nossa nova configuração eu vou ter o elétron o que foi promovido aqui para o eixo z no orbital p localizado aqui ó opa então quantos espaços livres a gente tem agora quantos elétrons desemparelhados quatro se liga só
eu tenho um um dois três quatro mais assim ainda não é como a gente encontra o carbono na natureza esse segundo estado que é um estado de maior energia nós chamaríamos gir estado excitado voltar aqui dois eita nós dois e o estado excitado ou estado ativado do átomo de carbono então e tal cão ele tá no nível de energia mais alto nem marquinhos mas na natureza de alimentos não buscam maior estabilidade aí é que vem a malandragem master do carbono o que que ele faz quando ele faz as quatro ligações você sabe que quando a
formação de ligação eu vou ter energia liberada então quando ele faz essas quatro ligações ele vai se hibridizar como átomo de carbono sp2 sp ou sp3 e aí o que que rola vai rolar um abaixamento na energia e aí nós vamos ter um novo estado que agora vai ser o estado e bridge usado para escrever aqui ó tô aqui em baixo então eu vou ter dois s numa energia mais baixa o 2px 2p y&o 2pz no novo estado que ser g1 o hibridizado então não necessariamente os quatro vão ter a mesma energia mas eu vou
ter uma daquelas grandes ações a habilitação sp sp2 e sp3 beleza então quando o átomo de carbono faz as quatro ligações ele vai para o estado de energia mais baixo então tipo assim ele investiu 21 sales para depois liberar 80 então ele vai realmente para uma cor se é para uma possibilidade de energia mais baixa ele vê caraca eu vou poder ficar mais estável do que eu já tava então o que acontece aqui ele passar para um terceiro estado que é o estado e brisado ao realizar suas quatro ligações e aí como é que essas
quatro ligações vão acontecer quais são as formações como é que eu vou ter a sobreposição de orbitais para formar hibridização sp sp2 sp3 é isso que a gente vai ver nos próximos quadros momento para você pintar e pintou partiu vamos entender então aí bilização sp sp2 sp3 guará então hibridização sp3 o carbono sp3 é aquele átomos de carbono que faz 4 ligações sigma beleza e aí que vai acontecer aqui é o seguinte eu tenho primeiro estado fundamental beleza o átomo de carbono podemos fazer apenas duas ligações esse é a turnê ser promovido por um subnível
mais energético vai ser excitado para um subnível mais energético e nós vamos ter o estado excitado e o que que vai acontecer essas quatro valências aqui ó vão ser preenchidas por ligações sigma ligações axiais tudo bem e aí essa ligação sigma quando as quatro ligações sigma acontecem você usa um hábito o s e três orbitais p para fazer ligação seguir vou fazer quatro ligação quase caiu pillow aqui mas não fazer quatro ligações sigmas então vou usar um homem da uece e três orbitais p sacou por isso que nós teremos e quatro orbitais aqui degenerados um
dois três quatro hibridizados sp3 então tem aqui ó os quatro aqui são sp3 e aí nós vamos ter os quatro elétrons do carbono 14 elétrons aqui do carbono e os quatro elétrons de outros dos outros elementos químicos na verdade que acabou de se ligou por exemplo se fossem quatro hidrogênios aquele carvão tivesse ligado então teria um par de elétrons aqui carbono hidrogénio outro par de elétrons carbono hidrogênio e carbono hidrogênio e carbono então os outros elétrons que estariam eles eu nem parelhados serem os alertas tiveram dos hidrogênios então vou ter isso aqui ó dois três
quatro então carbono fez quatro ligações e que tipo aqui quatro ligações do tipo sigma e ele usou um orbital s e três orbitais p para fazer essas quatro ligações do tipo cima por isso carbono hibridizado sp3 agora porque o que que lá nas reações orgânicas eu vejo que é sempre quando tem uma reação de adição sempre eu tenho uma geração uma aula geração uma hidratação o que que o raio da ligação que quebra é sempre a ligação pi porque a ligação pi ela é mais fraca o pão de energia mais alta você vê que ela
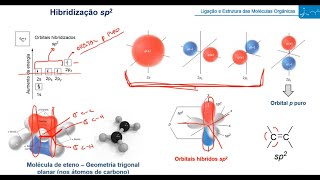
vai ficar aqui no nosso diagrama um pouquinho mais acima por isso que ela sempre quebra ela ligação um pouco mais fraca a ligação sigma e a ligação está na direção do eixo internuclear ela tá exatamente entre um átomo e outro a ligação que ela acontece em volta desse eixo axial e se acha internuclear beleza então 30 aí rapidinho hibridização sp3 tá espacinho para você pintou beleza vamos agora para o carbono hibridizado sp2 oi tá boa divinizado sp2 se liga nunca bom sp2 nós temos agora três ligações sigma e uma ligação então olha só que vai
rolar o mesmo esquema eu tenho o estado fundamental depois ele vai ser citado vamos pro estado ativado e o que que vai acontecer aqui nós temos que fazer três ligações sigma que vão ser sempre a prioridade e por último nós faremos as ligações pi beleza então nesses espaços aqui ó eu vou fazer primeiro ligação sigma vão colocar aqui em vermelho para se diferenciar usei para fazer ligação cima depois ligação sigma depois ligação cima agora o último eu vou usar para fazer uma ligação pi e aí pessoal quantos orbitais s enquanto sobre tais percuros eu usei
para fazer a ligação sigma eu usei um s e dois orbitais p entendeu porque da hibridização sp2 beleza então nós vamos para um novo estado agora nós teremos o abaixamento de energia só desses três aqui claro os 41 abaixar mas o abaixamento pronto tá o degenerado para mesmo nível de energia mas seu desses três acima que é uma ligação mais estável maior estabilidade e menor energia do sistema beleza então a gente vai ter isso aqui ó hoje três orbitais p e aqui degenerados e eu tenho aqui a ligação p e como energia um pouquinho mais
acima foi eu não foi então aqui ó nós temos a ligação sigma a ligação sigma a outra ligação sigma e aqui a ligação pi como energia um pouquinho e mais acima ó três aqui debaixo cima e aqui ligação pi então nós temos aqui três orbitais sigma sp2 em um psp 2 foi uma foi galera o pe como energia um pouquinho acima por isso que a ligação rir é menos estável e agora como será que o carbono sp tenho certeza que você já imagina que um nesses locais aqui vai ficar com energia um pouco mais acima
e aí nós teremos quantas ligações pi duas beleza se liga vou dar um espaço para você pintar e a gente parte por próximo quadro i perguntou então roda a página direto aí vai tá bom hibridizar sp mora eu sou o carbono hibridizado sp vai ser sempre o carbono linear tranquilo então nós temos duas possibilidade ou o carbono faz as duas ligações duplas ou ele faz uma tripla em uma simples nós temos as duas possibilidades para carbono sp beleza ah e não entendeu você tá ligado para oxigênio e um carbono para cá ele tá ligado com
o oxigênio para cá e nitrogênio para lá não importa o importante é o formato do átomo de carbono é um padrão de você que tá fazendo duas duplas uma cinco de matrícula não importa concolato uma esteja se ligando legal beleza então tá aqui duas duplas ou uma simples e uma tripla seria as foto galinha um lance é o seguinte aqui o que acontece de novo a mesma história primeiro estado fundamental eu e se tu esse elétron daqui ele vai para o subnível mais energético nós vamos ter estado excitado agora com e os quatro elétrons desemparelhados
e aí o que acontece depois de 4 elétrons desemparelhados eu vou usar é primeiro vou fazer ligações sigma e depois faça as ligações pi primeiro ligações do tipo sigma eu tenho esse espaço aqui que eu vou usar para fazer a ligação sigma e esse aqui que eu vou usar para fazer uma outra ligação sigma o pai então usei o hospital s o orbital p puro depois as outras duas são ligações pin então fiz aqui uma ligação pi e que outra ligação tem um bom então usei para fazer estima um hotel s e o hospital p
por isso hibridização sp foi ou não então aqui no sp nós teremos os dois orbitais sigma sp aqui fazendo a ligação sigma e bom então tem aqui ó sigma sp primeira ligação feita a segunda ligação sigma feita dois optar estigma sp e aí com energia um pouco mais acima dos hospitais ppi sp tá aqui ó assim uma pa dois hospitais signo sp um e dois ou três pe sp energia do ppi um pouco acima da energia do senhor por isso que alcinos reagem com aquelas duas ligações pi eles consomem dois irmãos de hidrogênio para poder
rolar em uma hidrogenação total auxílio virá o alcano ou seja consumir todas as ligações que tá na mão de ligações pi consome 1 mol de hidrogênio para poder ser quebrado show de bola então hibridização sp nós teremos aqui dois orbitais sigla sp e dois orbitais ppi sp fácil de manejar tira seu print e agora vamos enxergar melhor no exemplo que uma molécula do acetileno do et lu como é que essa ligação tripla vai acontecer como é que a ligação cima é chamado de ligação axial e o porquê do átomo está bom não fazer uma ligação
quádrupla beleza partiu então nosso próximo quadro pode pintar nós vamos laçar virar a página o cara o desenho ficou muito lindo galera então para vocês entenderem como é que esse lance de interação axial interação paralela ao eixo internuclear homem tem o seguinte aqui eu tô trabalhando lá em três beleza o ano xyz beleza tridimensional tranquilo então no centro tem o átomo de carbono e eu vou ter uns três orbitais p do átomo de carbono eu tenho que ir o orbital pz no eixo z px no eixo x e p y fy aquele tem o eixo
y beleza é questão de referencial poder ter colocado z para cá assim para cima eu escolhi botar z x y y x z tranquilo e aí coloquei o átomo de carbono no centro então o que está em vermelho aqui será o meu orbital p o xixi o que está em verde é o p y e o que tá em azul é o o peso os três opções da general então o que acontece quando vou fazer uma ligação sigma a interação vai ser uma interação axial então interação frontal ou seja para fazer uma ligação sigma eu
vou interagir esse eixo y aqui com esse aqui então tá aqui ó é a primeira ligação sigma sendo formada bom então na verdade essa ligação do meio aqui passando representar agora com uma ligação sigma então tá aqui ó a do meio ah sim beleza e aí fiz a ligação sim agora é a ligação pires eu tenho ligação pico eixo x e a ligação pi com eixo z se liga só com o eixo sim eu vou fazer ligação pin dois pontos ela vai ter um primeiro ponto de contato aqui ó lá atrás tá aqui ó primeiro
ponto de contato lá atrás oi e o segundo ponto de contato dessa ligação pi vai ser aqui ó eu tô na verdade eu tô fazendo essa ligação pi aqui ó é a primeira ligação que pode ser essa de senhor pode ser essa de baixo tanto faz então ligação pi ela fica no clã paralelo ao eixo da ligação sigma e ligação sigma tá aqui ó vou até fazer seria ligação no eixo internuclear porque eixo internuclear porque ela está exatamente na direção bem se carbono para esse calor exatamente na direção do centro 10 carbono do núcleo de
carbono para o outro por isso que a gente chama de interação axial foram e interação paralela ela tá abraçando a ligação sigma aqui ao redor dela por isso que a gente coloca cima pipe então aqui essa é a primeira ligação que eu tenho que opium e aqui embaixo e um beleza tá aqui ó a ligação tem um representada por esse traço por isso que é mais fraca ligação sigma pum a proximidade up não tem que fazer esse abraço esse contato um pouco mais distante por isso que ela é mais fraca foi ou não a ligação
pi tá aqui ó o pc vai ter esse ponto de contato aqui em cima e aí ó então até aqui ó primeiro ponto de contato da up2 deixa de ser opium aqui ficou muito apertado para ele tem um cara que tá ficando sinistro aí e agora o seguro ponto de contato da ligação pi vai ser aqui em baixo e recome o outro que uma aqui vamos lavar pagar ele vou colocar em outro lugar aqui vamos lá sair daqui pium eu tenho aqui em cima e aqui esse outro ponto de contato é o pi 2 é
o segundo ponto de contato da segunda ligação p então ligação pela é feita a bastante uma por cima e por baixo então você tem a ligação sigma aqui no meio a ligação abraçando ela numa primeira parte aqui e a ligação pi abraçando ela por cima e por baixo foi ou não tudo bem então aqui está representado a ligação tripla do átomo de carbono marquinhos em outra ligação a ligação simples que você faz aqui com esse hidrogênio são ligações sigma correto aqui ó ligação sigma e ligação sigma e ligação sigma vai ser feita quando está oeste
de hidrogênio aqui ó eu vou me ligar aqui e com o hidrogênio e do outro lado eu vou me ligar aqui também ó com outro átomo de hidrogênio então ficar hidrogênio carbono ligação tripla carbono-carbono foi ou não marques que o carbono então não pode fazer uma ligação quadra para o chão porque não pode fazer ligação quádrupla vai para cá imagina repulsão eletrônica que você tem aqui na ligação tripla só que ele é possível colocar mais uma ligação aqui então quatro ligações para uma única direção seria algo de uma estabilidade absurda você não teria disposição espacial
para isso aqui vou ter que torcer seu habitual para frente a repulsão eletrônica vai ser absurda então isso não seria possível por isso que você não encontra o carbono fazendo isso aqui no encontro carbono fazendo ligação quádrupla simplesmente porque você tem uma repulsão eletrônica absurda isso aqui não seria possível cara esse desenho ficou muito animal por favor print esta obra-prima do monstrão e aí a beleza agora e o tipo de ligação se eu tenho mulher com o destino é aqui nós temos uma ligação sigma spsp as oi sigma spsp como assim eu tenho a ligação
sigma desse carbono ligado a esse entre dois carbonos sp por isso que eu chamo de uma ligação signo spsp então é rapidamente isso é pedido para gente o que que é mais cobrado no vestibular você a determine qual o número de ligações pira uma molécula determine qual é o número de sei lá de carbonos sp2 num determinado composto então vou dar um exemplo pra vocês vamos lá próximo quadro partiu cara fica moral essa mulher que rodando lento em eu tô acreditando que eu consegui desenhar isso meu deus bora se liga só então seguinte vamos supor
que eu tenho a adrenalina aí eu peço para você para mim terminar com a hibridização de todos os átomos de carbono presente aqui na adrenalina então e é muito mais fácil do que toda esse bate-papo que a gente acabou de ter é na verdade você gravar aqui o carbono sp3 são quatro ligações sim o carbono sp2 tem uma dupla de dois centros o carbono sp pode ter dois formatos diferentes ele pode ser formado por duas duplas ou uma trip uma simples se liguem mostraram aqui primeiro nós vamos achar todos os átomos de carbono para depois
determinar todas as grandes ações então tem aqui ó um dois três quatro cinco seis átomos de carbono sete oito e são electrogéneos 9 átomos de carbonos todos esses carbono do anel repare comigo estão com esse formato aqui ó uma ligação dupla e 2 simples então todos esses ramones do anel são carbonos de que tipo sp2 então aqui o nós temos sp2 sp2 esse sp2 sp2 e esse sp2 e esse aqui sp a beleza agora parte para fora do anel nós temos esse átomo de carbono repare que só tá vendo ele fazer três ligações mas a
quarta é com hidrogênio maroto que na verdade está para traçar que lembra para trás eu uso a representação tracejada beleza então tem que o hidrogênio para trás então tá fazendo quatro ligações simples e bilização esse átomo de carbono vou colocar aqui em vez para diferenciar sp3 e esse aqui eu também tenho dois hidrogênios ele tá fazendo duas ligações simples e as outras duas só podem ser com o hidrogênio sp3 o outro carbono eu tenho aqui também o carbono sp3 porque ele vai fazer quatro ligações simples uma com esse nitrogênio e três ligações simples com hidrogênio
então quantos carbonos híbridos usados sp nós temos aqui nenhum quantos carbonos híbridos usados sp 2 1 2 3 4 5 6 carbonos o sp2 a beleza agora quantos carbonos sp3 eu tenho eu tenho um dois três carbonos psp3 a aí eu te peço mais uma coisa classifique essa ligação aqui ó dentro carbono vou apagar que o pretinho e vou colocar senhor destacada em verde classifique essa ligação entre carbonos não quer essa ligação entre dois carbonos um sp2 e um carbono sp3 correto é uma ligação simples então é uma ligação do tipo sigma é uma ligação
sigma mais uma ligação sigma qualquer é uma sigma sp2 psp3 como assim marquinhos sigma sp2 sp3 ela está conectando um carbono sp2 eita ela está conectando um carbono sp2 é um carbono rsmp3 beleza por isso que a ligação sigma sp2 sp3 tudo bem beleza tá aí agora de terminamos tudo que eu podia não olhar com a da dentro ali na nossa gosto muito depois é só com reconhecida com o trabalho para desenhar assim então é a mulher quando ano no marquinhos anuleno é um composto aromático ou não pessoal existe uma regrinha chamada a regra de
ruppell que determina se o composto é aromático ou não como você determina por exemplo essa parte aqui você sabe que era o mate que tem um anel benzênico mas na verdade é por conta de uma regra chamada regra de ruppell essa regra de hulk eu disse que se o seu composto tem cabeça fechada e possui 4 n + 2 elétrons pi 4 n + 2 você e tu e aqui quatro e mais dois é igual ao número de elétrons pi que você tem no seu composto orgânico o nosso a cadeia carbônica então se quatro e
mais dois me deu um resultado de inteiro se ele depois você substitui aqui o número de ar é transferir da o resultado inteiro um ter sinal de que são composto aromático por exemplo aqui quantos elétrons que a gente tem cada ligação é um par de elétrons não compartilhados então tem aqui ó um par o outro par outro para eu tenho 6 elétrons pi então 4 n + 2 aqui ser igual a quanto 4 n + 2 = 6 então é igual a quanto dois passaram para ao subtraindo 6 - 244 passa dividindo com a subir
quatro dá um então é igual a 1 ele é um número inteiro logo esse composto aromático e o ano lembro é automático vamos tirar prova real que agora quantos elétrons que o anuleno tem pessoal anuleno tem quantas ligações pi ele a ligação de duas três quatro cinco seis sete oito nove ligações pi esse composto caiu uma questão da fuvest em presta atenção então eu tenho 123456789 ligações pi se cada ligação que tem dois elétrons e o que acontece eu tenho 18 elétrons pi e aqui dentro dando lembro então 4 n + 2 é igual a
18 n = 16 sobre 4 = 4 opa em é um número inteiro é então anuleno é aromático é então tira isso da sua cabeça que a composto esse aromático ele tem que ter ah não ah um marshmallow benzênico não necessariamente pena né o benfeitor nem todo composto que tem anel benzênico aromático mas não necessariamente não ter anel benzênico não significa que esse composto não era mágico olha o dono lembro cara tem aqui quantos carbonos a gente tem conta comigo aqui ó 1 2 3 4 5 6 7 8 9 10 11 12 13 14
15 16 17 18 carbonos cara um anel de 18 carbonos aromático é o que obedece a regra desse camarada aqui chamado de regra de o rukio que a regra aqui quatro aí mais dois é igual ao número de elétrons pi se esse número for inteiro você tem um composto aromático beleza então todos os carbonos aqui no ano leno são carbonos de que tipo concorda comigo que são todos os carbonos sp2 sim ou não então todos os átomos de carbono presentes aqui são carbonos sp2 por exemplo vamos pegar uma ligação sigma qualquer aqui peguei essa é
só muda a cor e essa ligação sigma aqui eu tenho um carbono sp2 aqui e um carbono sp2 aqui então essa ligação sigma é uma ligação sigma sp2 o sp2 certo e se eu tivesse vou usar espaço daqui vão bora vão economizar pilão aqui ó se eu tivesse um estilo o cê triplas e que a gente viu agora pouco e no caso do estilo essa ligação tripla aqui vamos pegar up dessa tripa essa ligação pin essa é uma ligação pi sp sp para ela tá conectando dois carbonos híbridos usados sp foi eu não foi moleza
não é vou dar um espacinho para você pintar rapidamente printou show de bola mas uma única observação para a gente fechar as aula mostraram como é que eu vou fazer para desenhar ligação tripla você encontra em apostila em questão exercícios para afinar a senhora não faz isso cara não faz isso eu falei para você que no sp é sempre você não vai representar assim tu vai representar assim ó a linha show de bola então quantos átomos de carbono eu tenho essa molécula aqui determine a fórmula molecular dela aqui junto comigo vamos lá deixa eu ver
se já viemos aqui roubar então eu tenho conta primeiro comigo quantos carbonos 1 2 3 4 5 6 só manel sete oito nove dez onze doze treze beleza então certeza é o h quantos hidrogenios nós temos além do carboneto aqui no anel esses cavalos tem o hidrogênio porque ele já fez uma duas três ligações então o hidrogênio essa hidrogênio tem tem hidrogênio de hidrogênio de hidrogênio não tem hidrogênio já fez uma duas três quatro ligações não tem hidrogênio já fez quatro já fez quatro já fez quatro já fez quatro já fiz quatro aves quatro opa
esse daqui tem que ter hidrogênios a beleza quantos duas vezes nós temos um dois três quatro cinco seis sete oito c-13 h 18 e essa é a fórmula do nosso composto orgânico agora eu te peço para que você classifique e essa ligação pausa o vídeo e classificar essa ligação a ligação sigma sp sp sp sp dois classificam após o vídeo a beleza aguardar dando a resposta aí para esse nosso breve exercício eu tenho uma ligação sigma aqui entre um carbono sp2 e um carbono sp então a sigma sp2 em sp não foi eu não foi
galera quantos carbonos hibridizados sp2 e quantos sp eu tenho no anel todos são sp2 então nós já temos um dois três quatro cinco seis aqui eu tenho seis carbonos sp2 quantos carbonos sp um dois três quatro cinco seis seis carbonos sp e nós temos um carbono aqui no finalzinho hibridizado sp3 então um carbono sp3 fala para mim difícil molezinha né vai monstro tira seu presente a beleza fashion futuro hoje e por hoje é só galera e aí já se inscreveu no canal ainda não cara já somos mais de mil inscritos já somos mais de mil
nessa família que não para de crescer que tá a fim de estudar que está afim de aprender vem comigo vem compartilhar com ela que aí seus comentários deixa suas sugestões eu fico muito feliz de ver interação de vocês é muito bom é sempre muito bom tá aqui junto com vocês espero que essa aula possa ter te ajudado o que ela possa tecido muito útil para você até a próxima um beijo no seu coração valeu
Related Videos

1:41:13
LIVE - CLASSIFICAÇÃO DE CADEIAS CARBÔNICAS...
QUÍMICA DO MONSTRO
36,998 views

30:33
QUÍMICA ORGÂNICA - NOMENCLATURA
QUÍMICA DO MONSTRO
908,169 views

3:02:42
LIGAÇÕES QUÍMICAS
QUÍMICA DO MONSTRO
111,610 views

22:05
HIBRIDIZAÇÃO - Como Ocorre!
Professor Igor Química
24,262 views

31:33
Hybridization Theory (English)
PassChem: Sponholtz Productions
1,319,557 views

30:32
INTRODUÇÃO À QUÍMICA ORGÂNICA - PROPRIEDAD...
QUÍMICA DO MONSTRO
884,998 views

24:32
HIDROCARBONETOS - FÓRMULA GERAL E MASSA MOLAR
QUÍMICA DO MONSTRO
160,311 views

10:55
Hybridization of Atomic Orbitals - Sigma &...
The Organic Chemistry Tutor
2,367,607 views

1:15:01
INTRODUÇÃO QUÍMICA ORGÂNICA: Hibridação, E...
Marcelão da Química
335,101 views

3:10:31
FUNÇÕES ORGÂNICAS E ISOMERIA - RETA FINAL ...
QUÍMICA DO MONSTRO
9,538 views

1:10:15
A melhor aula de QUÍMICA INORGÂNICA que vo...
Pedro Assaad
18,938 views

19:47
Hibridação | Tudo que você precisa saber
Café com química - Prof Michel
374,413 views

1:16:21
LIVE - EXERCÍCIOS DE NOMENCLATURA NA QUÍMI...
QUÍMICA DO MONSTRO
47,452 views

44:24
REAÇÕES ORGÂNICAS - ADIÇÃO E ELIMINAÇÃO
QUÍMICA DO MONSTRO
252,089 views

15:48
Hibridização - Brasil Escola
Brasil Escola Oficial
29,640 views

24:29
Compostos Heterocíclicos - Lista 03
Iago Maciel
42 views

27:15
The Most Misunderstood Concept in Physics
Veritasium
15,632,590 views
38:09
Hibridização do Átomo de Carbono e Orbitai...
QUÍMICA PRIMORDIAL
1,934 views

36:08
FORÇAS INTERMOLECULARES
QUÍMICA DO MONSTRO
482,734 views