Episódio 13 - Agilizando!#1 (Catálise Heterogênea)
23.22k views2133 WordsCopy TextShare
Universidade da Química
A elaboração desse vídeo contou com as dicas da minha amiga, a Professora Joyce Barbosa.
www.univer...
Video Transcript:
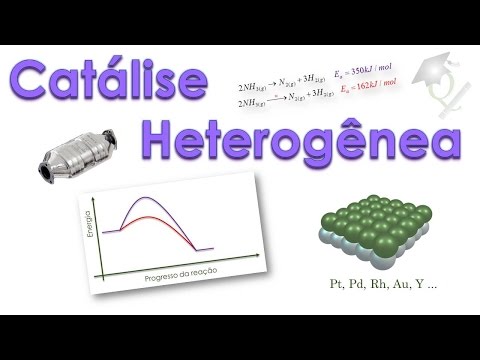
olá pessoal seja muito bem vindo a mais um vídeo da universidade da química eo episódio de hoje tem por tema agilizando agilizam o que na verdade agilizando as reações nós vimos o primeiro episódio desta série alguns fatores que nós podemos alterar para aumentar a velocidade de uma reação dentre eles temperatura pressão superfície de contato mas hoje nós vamos focar num desses fatores que são os catalisadores bom que são catalisadores catalisadores das espécies químicas cujo único objetivo de vida é aumentar a velocidade de uma reação acelerar uma reação os catalisadores portão do trabalho no campo da
cinética ele aumenta a cinética regional só que eles não interferem no campo gercino campo termodinâmico por exemplo parâmetros termodinâmicos não são alterados pela presença de um catalisador na legenda e big bi já a variação da entropia variação entropia a constante de equilíbrio não são alterados pelos catalisadores nós podemos ver aqui um exemplo é a relação entre o so2 e oxigênio molecular produzindo é só três essa reação é catalisado na presença de óxido nítrico na presença de nyon podemos perceber que o irã faz parte da lei de velocidade a velocidade da reação depende do nhoque com
os point doidos de uma reação de segunda ordem em função do catalisador porém na coxa de equilíbrio não parece simplesmente os produtos levados suficientes e que o metro cúbico dividindo um dos regentes e levados a seus respectivos coeficientes econométricos o catalisador não entra no conceito de equilíbrio e ele também não vou alterar nem o da garota genial jf como nós vamos ver mais à frente outra propriedade do catalisador é que ele não participa da reação global às vezes nós falamos de catalisador não participa da reação mas isso é conceitualmente errado muito bem aqui porque não
participa da reação global nós temos aqui onde decomposição do peróxido de hidrogênio catalisado pelo iodeto vai gerar a água e oxigênio molecular o mecanismo dessa reação passa por duas etapas a primeira é o peróxido de hidrogênio região do que o de tudo tirando água o óleo oi - o ipo e o dito eo egito por sua vez vai reagir com o peróxido de hidrogênio produzindo água oxigênio molecular seus produtos e devolvendo o iodeto não notem que o iodeto entra na reação e bagunça reação ele promove a reação porém ele é liberado da mesma forma como
entrou em termos líquidos não houve nenhuma mudança para o iodeto entre o dentro saiu de dentro então macroscopicamente nós dizemos que ele não reagiu porém microscopicamente dentro da relação entre a bagunça produz aqui facilita reação e depois de restaurado e isso é uma característica dos catalisadores eles acelera a velocidade da reação e são restaurados no final o que nos permite usar o catalisador mais uma vez mas o fato deles aumentar a velocidade da reação já intimamente relacionado com sua capacidade de induzir legitimação da etapa menta lembre se que é talento etapa determinante da reação como
catalisador diminui a energia da etapa lenta ele permite que mais moléculas atravesse superar essa barreira em um determinado intervalo de tempo e consequentemente reação ocorre mais rápido nós podemos ver que alguns exemplos eu tenho que um diagrama de energia esse patamar representa gente aqui representa o produto e que nós temos um determinado a reação reação por exemplo de decomposição da amônia em hidrogênio molecular hidrogênio molecular a barreira de ativação e legitimação para essa reação sem catalisador é 350 que o charolês por mall agora quando utiliza um catalisador utilizado por exemplo um bis tenho metálico a
barreira de ativação cai para 162 quase 200 quilos jogos a menos nós podemos notar que no gráfico a diferença a reação não capitalizada representada colocou uma rússia catalisada pela curva vermelho e aqui nós temos dois diferentes aproximadamente 200 quilos jales mais moléculas de regiões podem ser convertidas em produtos no intervalo de tempo menor outro exemplo de reação catalisado foi assim como os anteriormente a decomposição do peróxido de hidrogênio a barreira de ativação para essa reação 85 charles formol quando ela está capitalizado a presença de o dentro ela cai para 56 diminui legislação aumenta a velocidade
o interessante é que com o catalisador ele pode alterar a legitimação porque ele pode alterar o mecanismo da reação ele pode mudar a forma como a reação ocorre por exemplo a que nós temos esse outro diagrama tem uma determinada reação qualquer ocorrendo em três etapas nós achamos a presença de dois intermediários e três de estado de transição mas a reação catalisada pode passar por um mecanismo completamente diferente só para exemplificar reação catalisado vermelho passa em apenas duas etapas e o fato de passar por um mecanismo diferente permite com quem legitima são da etapa lenta da
etapa determinante da reação seja diferente entra em ação catalisada e gestão não capitalizada e narram canalizada sempre essa barreira de energia basta mais baixa o contrário do catalisador que nós chamamos de inibidor um inibidor e permite com que a reação ocorre de maneira mais demorada faz com que a relação seja mais lenta às vezes isso é interessante e como 'middle é desacelera a reação aumentando a energia e ativação aumentando a legitimação ação ocorre de maneira mais lenta o catalisador baixa energia e só ocorre de maneira mais rápida no momento nós representamos as reações catalisadas em
dois grupos a catálise heterogênea e acatáveis homogênea a diferença entre elas é bem simples a catálise heterogênea o catalisador e os regentes estão em fases diferentes o ponto tranqüila como estão do estado os físicos diferentes mas vamos aqui por exemplo a reação da amônia amônia gasosa o tungstênio metálico estão em fases diferentes portanto enquadra-se na catálise heterogênea na reação de baixo nós temos o iodeto em solução aquosa catalisando a decomposição do peróxido em solução aquosa ambos estão na mesma fase se estão a mesma fase nós chamamos de catálise homogênea no episódio de hoje nós vamos
focar na catálise heterogéneo e no próximo episódio à parte 2 dessa aula nós vamos tratar da catarinense homogênea quando nós falamos de catálise heterogênea 11 principal modelo que nós temos é o catalisador metálico nem fiquei catálise heterogênea baixo catalisador gente está em fases diferentes mas o mais comum nesses casos é o regente está ou na fase gasosa ou líquida e o catalisador está no estado sólido e esse catalisador normalmente você o metal eo metal nobre ouro platina paládio ódio entre o fim metade classificados como nobres consequentemente carlos nada impede do catalisador heterogêneos um líquido a
gente não estado gasoso o catalisador ser um óxido por exemplo se algum outro tipo de sólido mas a grande maioria das vezes eles são metais e metais nobres uma coisa que tem que ficar claro é que a catálise heterogênea um fenômeno de superfície a reação ocorre na superfície do catalisador na superfície do metal portanto é um exemplo de uma reação de absorção eu preciso que as moléculas de sejam absorvidas na superfície do metal então nós teremos a ocorrência da reação é uma distorção na maioria das vezes e química e aí o metal ele funciona como
a sudene uma espécie receptores de elétrons e de moléculas de reagentes se ligam ao metal como uma base de lewis doando o pajé metros e com isso em termos industriais e nos tipos de catalisadores o catalisador mas ico é constituído apenas um metal provavelmente dito isso em termos industriais não é muito viável e por que não viável lembre se qk thalisson heterogéneo é um fenômeno de absorção então quem interessa apenas a superfície do metal os átomos metálicos que são muito interior não serve de nada em termos catalíticos então o percurso de um metal nobre que
vai ser utilizado o processo mais comum é utilizar um suporte e suporte em informática office do que é muito mais barato ou alumina ou sílica óxido de alumínio óxido de silício de preferência com uma superfície bem porosa e nós recuperamos na melhor maneira possível da maneira mais homogêneo possível um catalisador sobre a superfície do metal nobre sobre essa superfície com isso eu tenho uma área muito grande recoberto com o catalisador gastando pouco do catalisador e se for por um uso melhor ainda porque o catalisador vai conseguir recuperar os poros aumentando a área de contato e
aumentando a eficiência catalítica com isso como disse tem uma área muito maior estando bem menos e essa maneira mais eficiente mais comum na verdade e se utilizar a catálise heterogênea o grande problema nesse caso é que a vida útil desse catalisador está atrelada à eva superfície continuar homogênea com o passar do tempo o fenômeno que nós chamamos de sinterização é como se esses átomos o catalisador metálico começa a se aglutinar começa a se aproximar como está representado nessa figura essa grade inferior suporte e aqui os átomos do catalisador começam a se juntar com o problema
disso a área superficial acaba diminuindo a área de contato diminui consideravelmente e o catalisador perde a sua eficiência hoje já há algum tempo este estudo de produzir chamados catalisadores inteligentes catalisadores que no próprio processo racional consegue voltar à sua forma homogênea consegue evitar esse fenômeno da interiorização infelizmente nós conhecemos muito pouco respeito do mecanismo da catálise heterogênea nós temos inúmeras ações importantíssimas com produção de amônia produção de ácido sulfúrico e hidrogênio china todas elas dependendo de um catalisador heterogéneo o nosso conhecimento sobre esse mecanismo não é muito bom conhecendo o mecanismo nós sabemos como é
a reação ocorre e com isso nós conseguimos melhorar o rendimento dela a reação mais conhecida é a reação de formação do gás carbônico ou dióxido de carbono através da reação do monóxido de carbono oxigênio molecular essa reação é catalisado através de um catalisador metálico de fato o jogador ter o gênio e o mecanismo é relativamente simples nós temos primeiro a extorsão do monóxido de carbono ele coordena ao sítio catalítico que o representado por um asterisco ele coordena ao metal através do átomo de carbono lembra que isso é uma reação à sua base news nós temos
aqui uma provável a distorção do carbono ele interage com 27 metálicos a segunda parte do mecanismo seria a distorção do átomo de oxigénio só que notem nesse processo a molécula de oxigênio é quebrada ocorre a dissociação nesse caso então nós temos dois átomos de oxigênio dissolvido na superfície do metal e agora quando nós temos as duas moléculas absorvidas mas chama da reação entre oxigênio atômico eo monóxido de carbono liberando o co2 e deixando o catalisador livre e mais uma vez se sente poderá ser usado para catalisar uma outra reação é essa reação que é promovida
dentro dos catalisadores automotivos catalisador do tipo de colméia aqui passa vários gases entre eles o monóxido de carbono que é produzido pela queima um completo de combustíveis fósseis ao passar pelo catalisador ele convertido em co2 com o passar do tempo o catalisador dentro da colméia sofre sinterização e é por isso que depois de alguns quilômetros rodados já estamos que trocar o refil do catalisador porque ele já perdeu sua eficiência esse tipo de mecanismo onde as duas moléculas outubro de moléculas de reação são primeiro dissolvidas para não ocorrer a reação é chamado de mecanismo de lang
mir preencher world esse mecanismo discutido e proposto por esses dois pesquisadores exatamente isso que a reação ocorrer todos têm que estar primeiro a dissolvidos esse não é um único padrão de mecanismo conhecido um mecanismo é alternativa ele o mecanismo de ribeirão e em lei onde nesse caso nós temos uma única molécula ou melhor o único reagente a dissolvido no catalisador e um outro agente está livre ele consegue reagir através de choque efetivos nesse caso como catalisador segurasse uma das moléculas para que ela registra de maneira eficiente a diferença básica entre estes dois mecanismos quando vai
ocorrer 11 quando ocorreu o outro é regido pela pressão total do sistema em uma determinada a pressão nós temos a preferência o mecanismo em outra pressão nós temos a preferência de outro mecanismo esses detalhes vocês vão ver apenas no curso de físico-química 2 onde vocês vão estudar fenômenos de superfície aqui para química geral acho que já tem informação suficiente ei pessoal gostou do vídeo bom eu espero que sim não perca a próxima aula vão falar sobre tratados homogêneo o complemento das aulas segunda parte dessa aula e se vocês gostaram do vídeo não se esqueçam de
um solar e que compartilhe deixe seu comentário com dúvidas críticas sugestões e se como por aquilo se inscreva a claro não deixe de acessar nosso site o www.universa.org.br e mika ponto com.br
Related Videos

17:38
Episódio 14 - Agilizando #2 (Catálise Homo...
Universidade da Química
14,462 views

15:44
Episódio 11 - Atrasando a Reação! (Reações...
Universidade da Química
15,940 views

14:35
Episódio 5 - Qual será sua concentração no...
Universidade da Química
43,201 views

26:57
MegaQuímica #3 Carga Nuclear Efetiva e Bli...
Universidade da Química
170,084 views

13:00
Episódio 1 - A corrida das moléculas ... (...
Universidade da Química
54,061 views

17:22
Episodio 4 - Colocando ordem nas coisas! (...
Universidade da Química
67,845 views

29:08
MegaQuímica #15 Ácidos e Bases Duros e Mol...
Universidade da Química
37,038 views

14:52
Episódio 12 - Como funcionam as coisas? (M...
Universidade da Química
33,084 views

39:33
MegaQuímica #14 Forças Intermoleculares
Universidade da Química
44,631 views

COMO FAZER O REENQUADRAMENTO DO MEI | 10.0...
Contabilidade Facilitada

14:45
Episódio 3 - Qual é sua velocidade agora? ...
Universidade da Química
38,012 views
31:27
Curso Química Geral - Termodinâmica #1 Tra...
Universidade da Química
60,940 views

14:45
Episódio #9 Quanto tempo você tem de vida?...
Universidade da Química
32,302 views

30:17
Tudo sobre orbital molecular #7 Diagrama d...
Universidade da Química
54,057 views

19:59
Curso Química Geral - Equilíbrio Químico #...
Universidade da Química
33,171 views

15:54
Episódio 2 - Quem corre mais? (Velocidade ...
Universidade da Química
26,666 views

0:50
A thousand uses of Dipyrone
Universidade da Química
2,977 views

12:38
Episódio 6 - Qual será sua concentração no...
Universidade da Química
24,854 views

17:02
Curso Química Geral - Cinética Química #1 ...
Universidade da Química
14,469 views

6:53
Episódio 7 - Qual será sua concentração no...
Universidade da Química
15,908 views