Espectrometria de Massas - Parte 3 - Solomons Capítulo 09
2.23k views3468 WordsCopy TextShare
Prof. Luiz Cláudio A. Barbosa
Este vídeo é a continuação da Parte 2 .
Assunto: Isótopos em espectrometria de massas.
Espectro de ...
Video Transcript:
tá dando continuidade ao estudo do capítulo 9 do sol vamos nosso livro-texto onde aperta até o momento nós já vimos sobre ressonância magnética nuclear vamos agora estudar espectrometria de massa de uma forma resumida é claro eu chamo atenção mais uma vez que esses slides não são de minha autoria foram preparados pelos professores william e filipe filhos sean e com autorização do grupo gênero eu fiz a tradução e gravação estou apresentando para vocês o tanto esse material deve ser apresenta utilizado apenas no contexto dessa disciplina e não deve ser repassado para nenhum outro fim a comercialização
obviamente aqui em reprodução divulgação para qualquer outro fim é proibido de acordo com a lei a e retornando agora na parte 4 vamos falar um pouco sobre isótopos em espectrometria de massa e aí bom então fiquem com esses principais mecanismos de fragmentação que nós mostramos resumindo clivagem de ligação de uma ligação simples clivagem vizinha a um heteroatomo que tem um par de elétrons não ligante clivagem a lilica clivagem brasílica eu vi arranjo de maxilar forte e aquele velho arranjo envolvendo migração 214 de hidrogênio durante a eliminação de água de aulas vamos falar um pouco agora
sobre os óculos porque no caso da espectrometria de massa aqui a gente mede é massa mas a gente não pode esquecer que a massa quando se calcula a massa molecular o a massa de ar direto você só mais massas atômicas dos elementos constituintes quando a gente fala de carbono nossa os óculos mais comum acabando 12 que corresponde a aproximadamente 98,9 por cento em termos de abundância na natureza o carbono 13 é aproximadamente 1,1 5,07 por cento o hidrogênio é predominantemente é formado pelo isótopo um que tem porcentagem abundância natural 99,99 por cento os óculos pesado
chá eu tô aqui pesado um deutério ele é muito pouco abundante na natureza mas você observa que alguns elementos como o cloro vocês encontram das tabelas periódicas a massa do cloro como 135,5 mas é esse valor é o em a massa do bromo como sendo 80 mas esses valores são médias ponderadas as observe que o cloro ele tem um isótopo com massa 35 que corresponde a aproximadamente 75 por cento em termos de abundância natural e o cloro e tem o ele o isótopo 37 com abundância natural aproximadamente é 25 porcento arredondando 75/25 você mostrar aqui
é 3 para um em termos de abundância o bromo 79 ter abundância em toda de 50 assim também o bromo 81 você já proporção desses dois isótopos de aproximadamente 1 para 1 e de modo que é importante que a gente saiba dessas não não que saiba de pó que você tem uma tabela com as massas desses isótopos com as abundâncias naturais porque na análise do estepe de massa a gente vai utilizar esses dados tá se observa aqui um enxofre aqui olha enxofre o shopping tá aqui um chopp o isótopo 32 94,9 33076 34 com abundância
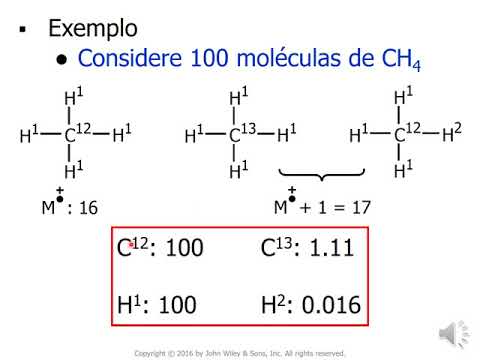
significativo de 4,3 por centro bom então os elementos que nos interessa o que agora de imediato vamos falar de carbono os dois isótopos naturais são 12 e 13 em todo de 1,1 por cento de todos os átomos de carbono na natureza são cabana 13 em torno de 98,9 por cento das moléculas de metano numa mostra tá manter a acabando 12 os demais um vilão por cento corresponderam a carbono três então observa o seguinte considera que você tem 100 moléculas de metano ah tá a massa molar do metano que a gente sempre consideram 1616 por quê
que é o isótopo-12 é o mais abundante o isótopo um é mais abundante do de combate 16 pode ser que algumas dessas moléculas tem o cabelo 13 se ela tiver um carbono 13 ou se tiver acabando 12 e um deutério a massa vai ser 17 e seu final chamamos tá no esperto demais do pico m mais um 1 m mais ponto é o 16 wayne mais um é o pico 17 lá no primeiro slide é o mostrei um pico action uma blusa é muito pequena que falei que era devido a isótopos aqui tá origem daquele
pico que corresponde a massa molecular vai quando um dos isótopos menos abundantes são lá detectados bom então 100% se você considerar de 100 porcento do carbono do que o carbono-12 corresponde a 100 porcento abundância do treze é um vírgula um processo em relação a ele tá se você considerar que o mais abundante é sem o deutério é 00161 ah tá então observa o seguinte de cada 100 moléculas de metano 1,1 moléculas claro não existe 1,1 moléculas e mas é claro que isso é só proporção onde você tiver um número gigante de moléculas é um visual
moléculas comprar islote de carvão 13 e o a quantidade muito menor são quatro de hidrogênios abundância dele 00169 fração muito pequena na tacada sem esse número tá vai poder o deutério o tanto essa tipo de molécula que basicamente desprezível 0064 quanto em esses molécula elas vão contribuir para o aparecimento do pico e mais junto não pico isotrópico aí em função de um desses dois isótopos a porcentagem a intensidade desse pico para um composto que tem apenas um átomo de carbono e aproximadamente 1,1 esse esses o deutério de modo geral a gente até despreza tá quando
não tentar de hidrogênio na molécula em resumo pela intensidade do pico m mais um é possível você saber é possível você calcular quantos átomos de carbono na molécula tem e você pega o pico m mais um assim a intensidade dele 1,1 tá você a partir daí calcula vamos fazer exercício sobre isso durante a aula é só observa aqui no quadro tá cheião piccolo m mais tá tem lá eu fico mais abundante eu fico e mais um esse sempre muito pequeno tá frase vamos você tem um bico aqui olha o que eu sei processo então que
esse composto tenha 10 átomos de carbono 10 átomos de carbono considerando apenas os átomos de carbono qual seria intensidade desse vídeo aqui 10 vezes 1,1 11 a feb foi desprezando de um exóticos do pico em mais um gerar é gerada em função do biotério porque ele é muito muito menos abundante do carbono então se o composto tem 10 átomos de carbono o picolé me mais um esse 1,1 vezes 10 que dá 11 essas palavras se você tem no espectro de massa e esse fico meme mais um é 11 em relação a esse ficou animais é
11 por centro dividir 11 por 1,1 da 10 você é a partir daqui descobre quantos átomos de carbono olha como que você poderoso claro que tem alguns detalhes que a gente deve considerar esse cálculo em alguns cuidados que a gente deve tomar mas é possível pela intensidade do pico meme mais um calcular é o nome de átomo de carbono na molécula eu vou fazer netos ao mundo também eu já mencionei em moléculas orgânicas de férias até por duas habilidades de massa já chamei atenção disso oxigênio de oxigênio dezesseis dezoito no shopping tem 32 34 cloro-35
37 brotem 7981 apontei para vocês quando eu falei da tabela nós chamamos atenção novamente aqui porque esses são os elementos que dão origem ao o m mais dois e os mais comuns nos compostos orgânicos é particularmente fácil identificar a presença de cloro ou bromo usando espectrometria de massa que vários exóticos de cloro e bromo são relativamente abundante os vários aqui são os dois do cloro e os dois no bloco tá em breve abundância de cloro já mencionei anteriormente 75/5 e do cloro 37242 vamos perto de massa você espera encontrar tá voz pico separados por duas
unidades em proporção aproximadamente três para um eu já havia mencionado isso para vocês e observa aqui espécie de massa do cloro benzeno olha aqui a intensidade desse pintor de 30 parceiro a intensidade este é o principal 100% esse é o pico do íon molecular esse é o pico m mais dois como esse composto tem seis átomos de carbono se você medir com cuidado aqui você vai observar que intensidade desse pico aqui olha é seis vezes 1,1 daí eu tô de 6,7 por cento em relação ao pico base é o próprio pico do íon molecular ah
tá e este composto tem massa molar sempre 12 e aqui 114 e a perda de um átomo de cloro resulta no fragmento com m sobre z77 observa aqui tem um 77 má notícia 39 não tem mais dois aqui porque não tem cloro daqui para cá perto de um átomo de cloro tô a perda de 35 no step de massa a lenda presença de dois picos m&m mais dois pó intensidade relativa de um para três é indicação clara de que existe um átomo de cloro na molécula observa que aqui agora presença de cloro pode ser mais
facilmente determinada identificada por espectrometria de massas do que por espectroscopia no infravermelho é claro que esse 77 continua fragmentando outros fragmentos no caso do bruno o isótipo 79 ele tem abundância natural 51,5 por cento o exótico 8149 meio por cento aproximadamente um para um então nós esperamos encontrar dois picos separados por duas unidades de massa uma proporção aproximada de 1 para 1 se o composto tiver um átomo cromo só observo aqui brometo de benzila observa características interessantes aqui agora esse aqui é a massa molar do brometo de benzila tem que calcular este aqui para saber
exatamente quanto que seria tá é seria 91 que corresponde a este fragmento aqui 9179 vai dar 10/180 não 180 o 9179 170 é esse aqui tem massa 175 172 esse é um pico em mais esse é o m mais dois em seu ia molecular e seu pico e mais 2 porque o que é a como abundância natural do bromo tá dos dois isótopos é um para um vocês tem que vai ver dois picos separados por duas unidades então esse indicação claríssima tá definitiva para a presença de um átomo de bromo da molécula mas observe que
no caso do cloro aquele fica eu fico base esse pico aqui olha em menos de 10 porcento porquê que aquele vagem nessa posição vai dar o cátion benzílico ôca tropilio desculpa é um cátion físico o caso de um tropilho ele era o mágico esse é o pico mais é a abundante o pico base esse é o pico do ir molecular.com mais ponto esse eu e mais dois será que é clivagem nesta posição ela favorecida e depois voltas clivagens observa-se observadas se você pegar essa massa aqui a 170 subtrair 91 você vai encontrar 79 a perda
de um fragmento olha um fragmento 79 eu tô sempre pegando o 79 é a massa do composto formado pelo islote de menor massa aqui é um 79 indica claramente que tem um átomo de bromo mas os dois picos aqui olha certeza que tem bloco muito mais fácil tem que ficar bravo aqui do que por infravermelho e por último tópico que eu vou mencionar para vocês para terminar essa aula tá e depois passarmos para resolver alguns exercícios tirar dúvidas é espectrometria de massa de alta resolução até agora não falei nada disso mas o detector de massas
de massa de baixa resolução assim chamados né tá entre aspas aqui e baixa resolução eles medem a razão em barra z apenas em com o números inteiros é possível distinguir apenas números inteiros em outras palavras você registra no espectro de massa fico sem um bico 101,102 só registra a massa inteira tá agora o espectro de espectrômetros de alta resolução eles medem os valores de m sobre z341 mais casas decimais dependendo da resolução do aparelho tá a gente usa pelo menos com 4 casas decimais o me dá os valores de emissor e quando eu quero determinar
a massa exata de um composto de um composto ou de um fragmento tá como as massas dos átomos individuais não são inteiras já mostrei pra vocês uma tabela que eu chamei atenção que importante que vocês tenham aquela tabela em mãos na hora de ficar de fazer um estudo sobre espectrometria de massas é uma espécie de massa de alta resolução ele pode ser usado para determinar a fórmula molecular aqui tem um aspecto importantíssimo na espectrometria de massa se você tem uma massa exata uma massa com quatro casas decimais no meio desta mata é possível determinar a
fórmula molecular e se não mais precisa aqui agora e fazer análise de combustão essa massa de alta resolução substitui análise observe aqui a massa aqui ó tabela de março exata novamente a nossa de hidrogênio não é uma gente fala que é uma não é um é 1,007 83 isso aqui arredondando para cinco casa cinco desse mais na verdade se vocês vão encontrar esses valores com mais casos consigo o suficiente o carbono-12 que é o padrão utilizado para calcular as massas de todos os elementos ele foi está que ele foi é considerado como 12 tá e
observe que o carvão três não é 13 é 13,00 36 oxigênio que a gente fala que é 16 vai mesmo é 15 pontos 9949 e vai por aí afora então essas massas exatas elas devem ser e quando nós estamos fazendo uso fazendo análise como espectrômetro de massa de alta resolução é essa tabela não traduzir porque veio com uma imagem mas eu acho que não atrapalhem o estudo de vocês é e vamos ver um exemplo aqui agora tá observa que o oxigênio hidrazina e metanol todos que massa molar = 32 por espectrometria de massa de baixa
resolução vamos arredondar que 16 com 16 3214 com 14 28 com 4 32 a 15 um dos e h3 com 17 tô a cada 32 mas as massas exatas são diferentes entre si observe o oxigênio a massa exata é duas vezes 15,99 49 que dá 31,9 898 a hidrazina duas vezes 1400 31 mais quatro vezes 1,007 83 que dá 32,0 375 como essas massas são diferentes o espectrômetro de massa distingue claramente e do metanol fazer a mesma conta vai dar 32062 então se você faz análise por espectrometria de massa de baixa resolução e tem um
pico em 32 poderia ser oxigênio hidrazina ou metanol é mas se você usa massa exata com quatro que tem o resultado com quatro casas decimais você tem a única combinação que vai dar esse valor são dois oxigênios a única combinação de átomos que vai dar esse valor dois nitrogênios e quatro hidrogênios e a única combinação que vai dar esse valor é ch4 ó é claro que gti erros nas medidas que isso tem que ser considerados nas análises mas se você tiver um aparelho com precisão em de 4 5 casas você consegue determinar a fórmula do
composto apenas pela análise da massa do pico o outro exemplo se você tem dois compostos c3 h8 ó no c2 h4 22 compostos e massa mauá 60 se você somar as massas atômicas dessa forma e as massas dessa forma usando números inteiros nós vamos ver que o valor é certa mas as massas exatas são diferentes c3 h8 a dois fazendo a conta com aquela tabela de massa exata você vai ter 60,0 5754 no outro composto 60,0 212 observa que pela massa exata você consegue é obter a fórmula molecular antigamente os aparelhos antigos época ainda que
o elo estudante a gente utilizava tabelas de massas risadas existiam livros ou massa de exatas tá baladas na próprio silva eles têm é existe umas tabelas pequenas mais ainda tem com massas exatas tá atualmente essas massas de exatas são todas é encontradas em bancos de dados no aparelho quando você faz uma análise de banco por espectrometria de massa de alta resolução o próprio equipamento jackson fornece uma lista de possíveis combinações de átomos que correspondem aquela massa exata daí você tem que fazer uma análise para escolher qual que vai ser a mais a aqui é de
fato correta e nós estamos chegando ao final do capítulo e nas últimas páginas aí do capítulo existe alguns comentários sobre algumas técnicas entre espectrometria de massa e está associada a cromatografia gasosa por exemplo essa técnica muito comum para análise de componentes voláteis para análise de misturas complexas a muito útil para dar ares de óleos voláteis óleos essenciais vitaminas enfim qualquer tipo de mistura complexa tá nesse caso esse sistema é composto de duas partes uma parte que corresponde a um cromatógrafo a gás representado por essa por essa parte aqui desse dessa imagem no no caso do
cromatógrafo a gás nós temos a coluna capilar geralmente sílica fundida a nossa engenheiro em injetada por meio de uma seringa por exemplo nessa coluna ela essa mistura vai passando e é pela coluna sendo empurrada por um gás e neste processo que ela vai passando pela coluna vai correr da separação dos componentes e na saída da coluna os componentes vão sair de um assim que o componente sai pela coluna o detector aqui olha é um é um detector de massas nesse caso ilustrado é você tem aqui uma fonte de elétrons quando nós falamos geralmente 70 elétron-volts
cada amostra é bombardeado e geram íons esses rios então são direcionados para essa região é chamada região de separação de ios os rios são separados detectados e depois isso é isso é registrável e daí a gente vai obter um cromatograma que já denominado cromatograma de íons totais é por meio da análise do cromatograma do espectro de massa de cada um dos componentes é possível identificar os componentes fazer análise o direito é só a técnica muito interessante muito útil muito importante nós temos algumas dezenas de artigos publicados entregando essa técnica principalmente artigos com óleos essenciais ácidos
graxos e fica aqui a informação apenas para quem se interessa por essa técnica depois pode me perguntar e nós conversamos um pouco mais sobre ela após a aula esse é o informação adicional também nós mostramos exemplos de moléculas pequenas fragmentação fragmentações de moléculas bem pequenas mas é espectrometria de massas ela extremamente útil também no estudo de biomoléculas como proteínas e polissacarídeos e etc os avanços da espectrometria de massa então tornaram essa técnica extremamente útil para análise de moléculas grandes biomoléculas tá para isso existem técnicas especiais de ionização tá uma dessas técnicas ela é conhecida pela
sigla molde que em português significa ionização o distorção a laser assistida por uma atriz e existem outras técnicas de ionização suave ou seja a técnica de setembro elétron-volts é uma técnica aqui a mostra é bombardeada com a quantidade vão com esses elétrons mais energia é uma quantidade um grande de energia mas existem métodos mais brandos em que a molécula é ironizada mas não sofre tanta fragmentação essas técnicas são úteis para compostos que são pouco voláteis como macromoléculas como já mencionei proteínas ácidos nucleicos e outros compostos tá é possível determinar componentes com massas moleculares superiores até
mesmo sem 1.000 daltons é uma outra técnica bastante suave é conhecida aí com ionização por splend eletro ou do inglês eletrospray o rolo alisador de massa do tipo 4 polos essa tec de rotina para também para análise de biomoléculas a e vocês devem ter ouvido falar o vão ouvir falar da técnica chamado maldi-tof esse tosse aqui é um é chamado de uma sigla também para um tipo de sistema de separação dos rios e chamado tempo de voo type of flight de inglês tempo de volta esses comentários finais apenas para que vocês saibam que as técnicas
espectrometria de massa ela é uma das que avançou muito nas últimas décadas aplicação dela é extremamente ampla desde componentes muito voláteis até componentes praticamente com não vá lápis como proteínas de alta massa molecular então existem combinações de a organização processo de separação dos rios e de detecção resultando em aparelhos com arquiteturas bastante variadas o que é útil para cada tipo de aplicação tá nós chegamos ao final do capítulo bom chegamos ao final do capítulo como sempre uma mensagem final é foi uma apresentação bastante resumida sobre a técnica de espectrometria de massa é para que você
já tem já comecem a se familiarizar com essa técnica extremamente útil na investigação da estrutura de compostos orgânicos nos próximos capítulos é essa técnica vai ser empregada e ao final do curso você já terão adquirido pouco mais de experiência um pouco mais de conhecimento sobre a técnica como sempre eu recomendo estudo e o capítulo do nosso de texto resolva os exercícios igual estudo para todos
Related Videos
15:53
Elucidação estrutural Exercício resolvid...
Prof. Luiz Cláudio A. Barbosa
1,674 views

Israel vs Iran War LIVE | Israel vs Iran N...
CNN-News18

17:22
Parafusos Industriais - Parte 02
Conhecimento 3.0
10 views

LIVE | Iran Missile Attack On Israel Start...
Hindustan Times

1:39:53
Aula de Jubilação do Professor Amílcar Soares
Instituto Superior Técnico
733 views

26:38
Les visions d'Odin | Les mythes vikings (1...
ARTE
100,438 views
30:36
Haletos orgânicos Introdução às reações ...
Prof. Luiz Cláudio A. Barbosa
106 views

18:14
Derivados de Ácidos carboxílicos - Estrut...
Prof. Luiz Cláudio A. Barbosa
422 views
34:13
Ácidos Carboxílicos - Nomenclatura - Parte 3
Prof. Luiz Cláudio A. Barbosa
399 views

2:26:33
CBN Noite Total - 30/09/2024
Rádio CBN
2,764 views

1:49:09
Leilão ANEEL | TRANSMISSÃO DE ENERGIA ELÉT...
B3
4,836 views

1:58:39
Prof. Silvio Micali - 02/10/2024 - Confere...
Fondazione "I Lincei per la Scuola"
236 views

45:20
Derivados de Ácidos carboxílicos - Amidas ...
Prof. Luiz Cláudio A. Barbosa
224 views
29:51
Derivados de Ácidos carboxílicos - Anidr...
Prof. Luiz Cláudio A. Barbosa
341 views

36:21
Derivados de Ácidos carboxílicos - Éstere...
Prof. Luiz Cláudio A. Barbosa
292 views

CANAL 24 HORAS 🔴 EN DIRECTO: TODA LA INFO...
RTVE Noticias

16:08
Destilação por arraste a vapor
Prof. Luiz Cláudio A. Barbosa
2,062 views

1:11:15
Thought Leaders Series: The future of geos...
Engineers Australia
636 views

18:04
Derivados de Ácidos carboxílicos - Nitrila...
Prof. Luiz Cláudio A. Barbosa
287 views

11:44
Protein Purification
Creative BioMart
236,689 views