Audiência pública para discussão e atualização do marco regulatório de fitoterápicos
503 просмотров32249 СловКопировать текстПоделиться

Agência Nacional de Vigilância Sanitária
Audiência pública para discussão das consultas públicas para atualização do marco regulatório de fit...
Транскрипция видео:
muito bom dia a todos Obrigado a todos aí pela presença aqui para pra nossa discussão pra nossa audiência pública a gente vai dar início aqui depois de de aguardar durante 15 minutos aí um tempinho eu vi que as pessoas ainda estão chegando mas eh em respeito também ao horário que já estava previamente estabelecido e a necessidade também da gente conseguir avançar aqui porque são quatro consultas públicas mais um edital que a gente tem também para discutir hoje então Eh damos início à audiência pública para discussão das propostas de consultas públicas 1290 1291 1292 e 1293
referentes à revisão do marco regulatório para registro e notificação de fitoterápicos industrializados à consultas públicas foram publicadas entre novembro e dezembro do ano passado e elas estão abertas a contribuições até o início do mês de março agora então em cerca de 30 dias ainda para eh contribuições passar eh eu sou o João Paulo perfeito sou o gerente da gmesp que é a gerência responsável pela avaliação e a regulamentação pro registro ah de de medicamentos específicos fitoterápicos dinamizados notificados e gases medicinais e companha a mesa aqui comigo Raquel marcolongo que é a gerente substituta da gesp
e o meu colega e Rogério Barbosa que também é especialista da gesp e a Ana Cecília e que também é especialista da gemes E trabalhou ativamente na construção dessas propostas de consulta pú pública do relatório de análise de impacto regulatório e que vai fazer as apresentações hoje aqui pra gente eh previamente ao início das nossas discussões eh o o objetivo eh nosso hoje é obviamente discutir os textos disponibilizados né para contribuições públicas referentes então ao registro e a notificação de medicamentos fitoterápicos e produtos tradicionais fitoterápicos industrializados ah a não são objetos de discussões aqui neste
momento eh terápico eh manipulados sejam farmácia de manipulação ou farmácias vivas ah ou outros produtos de comunidades tradicionais por exemplo eh e o nosso intuito específico é tirar dúvidas e esclarecer alguns entendimentos Que por ventura possam eh não ter ficado muito claros para que todos vocês possam eh enviar as contribuições lá por meio do formulário específico de cada uma das consultas públicas dentro do prazo previsto quem já tiver enviado quiser fazer alguma emenda ou alguma complementação é possível também eh e eh em respeito ao tempo também que é curto a gente vai se limitar a
fazer as discussões que estão relacionadas especificamente aos textos dessas consultas públicas e não entraremos em outras discussões eh relacionadas a outras normas eh que estejam ainda vinculadas ao registro até a farmacopeia brasileira que tem vínculo que possam ter vínculo com esse tema tá eh obviamente questões que abarquem a a proposta eh estarão aí passíveis de discussão eh no dia de hoje não tá [Música] passando a gente tem algumas orientações de início para informar como vai funcionar a o nosso dia de hoje então a a audiência pública é presidida por essa mesa que aqui está no
nós quatro eh tentaremos conduzir as discussões a partir dos elementos que vocês também trouxerem enquanto dúvidas ou considerações eh dividiremos a a audiência em dois blocos hoje então a gente vai debater primeiramente a consulta pública 1290 que é referente a RDC que altera RDC 26 de 2014 trazendo os pontos principais aí é é a consulta pública talvez mais extensa e aqui talvez ten um mais dúvidas e considerações a fazer também e logo após a apresentação dessa parte e dessa consulta pública pela Ana Cília eh que vai envolver também um pouquinho do relatório de análise de
impacto regulatório para contextualizar a mudança a gente abre paraas considerações então eh a gente vai abrir as inscrições para que vocês eh entreguem os formulários que vocês receberam preenchidos com a considerações de vocês e a partir da ordem de entrega desses formulários a a nossa colega Kei vai eh conduzir aí a chamada para que cada um de vocês se dirijam até esse púpito que tá aqui em baixo para fazer eh oralmente as manifestações de vocês considerando que o evento tá sendo gravado e depois a gente irá disponibilizar essa gravação por meio do Portal da Anvisa
para outras pessoas que não puderam estar aqui hoje presencialmente eh mas que tem interesse eh em acompanhar as discussões que aqui estão sendo feitas serão feit no dia de hoje né Então as participações Eh ok terminado esse primeiro bloco A gente segue para um pequeno intervalo de 10 minutos e aí a gente retorna eh com uma nova apresentação aí abarcando as consultas públicas de 1291 a 1293 e assim que a apresentação for finalizada a gente abre novamente também para inscrições das manifestações e a gente segue como na primeira parte Tá certo as participações então serão
orais as inscrições serão feit por meio da mesa receptora que está aqui a a a minha esquerda à direita de vocês eh por meio dos formulários impressos que vocês receberam Quem ainda não não recebeu o favor eh solicitar o formulário eh a gente solicita que vocês façam um pronunciamento por participante né chamado por ordem de inscrição em cada um dos dois blocos que a gente vidir eh e o participante terá 3 minutos pros questionamentos né e não não tem a possibilidade de réplica nesse primeiro momento porque a nossa intenção é que a gente possibilite a
participação aqui de todos que estão presentes e que tiverem interesse em se manifestar mas havendo a oportunidade e tempo suficiente obviamente que a gente tem a oportunidade de dar continuidade alguma discussão que de repente não tenha ficado muito claro ã a gente vai fazer o posicionamento da mesa a cada três participações orais então abrimos paraa manifestação de três pessoas que vai fazer as suas considerações aqui as colocar as suas dúvidas e a gente responde a cada três eh manifestações h a mesa pode manifestar sempre que necessário com prioridade de ordem Há possibilidade de questionamento por
escrito também ao final das manifestações orais Mas isso é para casos em que de fato eh a Existe alguma limitação que a pessoa não não possa fazer fazer a sua sua inscrição entregá-la e vir até o púlpito tá no final a gente abre também a possibilidade para para manifestação eh enviada por escrito a gente vai liberar um um QR code para para quem não puder utilizar o formulário impresso eh reforço que o o objetivo aqui hoje é a gente trazer os esclarecimentos eh para que as contribuições estejam alinhadas aí com com o objetivo desde o
início dessas discussões então esclarecer alguns pontos da Norma a ideia que hoje não é em se eh coletar eh contribuições eh referentes às consultas públicas as contribuições a gente pede solicita que elas sejam feitas todas por meio do formulário específico de cada uma das consultas públicas que estão disponíveis lá no Anvisa leges e que foram foi divulgado junto com a notícia no portal da Anvisa que divulga essas a a essa audiência pública Tá certo então eh finalizada essa essa audiência pública de hoje dentro de alguns dias até o início da próxima semana a gente pretende
disponibilizar a gravação no portal da Anvisa e eh a gente também fará um relatório com as principais considerações e os principais pontos de debate realizados aqui hoje eh esse relatório ele será construído por nós a partir das discussões aqui realizadas e ele ainda passa Então por uma avaliação da diretoria colegiada e quando aprovado ele ele também será disponibilizado eh no portal da Anvisa então Eh eram esses os os pontos principais Só lembrando eh das contribuições Não tá passando né Por favor reg eh peço para que as contribuições então sejam feitas via eh anvis lege só
lembrando que na na notícia que divulgou Então essa audiência pública tem um link para todos os textos que a gente vai discutir aqui hoje e pros formulários relacionados a cada uma dessas consultas públicas que é onde deverão ser feitas as contribuições então então Eh Espero que o dia seja bastante produtivo proveitoso e a gente consiga trazer aqui discussões importantes ah paraa melhoria do marco regulatório Considerando que as discussões eh referentes a essas consultas públicas como vocês puderam notar no relatório de análise de impacto regulatório elas já TM mais de 10 anos então a gente tá
hoje também assumindo e internalizando alguns conceitos que já estão previstos na farmacopeia brasileira em uma estratégia de convergência regulatória eh internacional aí principalmente com os elementos e com os requisitos estabelecidos pela agência europeia de medicamentos então desejo aí uma boa audiência a todos e eu peço a Ana Cília Carvalho que dê início à apresentação eh com as considerações iniciais e o primeiro bloco apresentando eh o relatório de análise de impacto regulatório brevemente e a consulta pública 1290 Bom dia [Música] pelo menos 12 anos que a gente discute porque eu entendo muito pessoalmente que o Brasil
entendeu a controlar fitoterápicos de um modo que não é o mais adequado e foi um processo todo mundo passar a entender isso a academia não entendia eh as as pessoas quando a gente discutia não entendiam mas a gente entende que hoje tá todo mundo mais adequado mais apropriado todo mundo dominou mais esse conhecimento e viu que realmente é um modo mais simples mais adequado de de regulamentar o controle quantitativo do fitoterápico porque a discussão básica é essa né É isso que a gente vem discutindo há anos e como fazer essa mudança Porque a gente já
tinha um perfil diferente que precisa se adequar a esse novo perfil que é o mais utilizado no mundo todo então A ideia é essa é trazer essas inovações paraa Nossa legislação isso tá nas mudanças do guia na mudança da Norma principal que a gente vai discutir aqui a gente é ambicioso e tem a intenção de apresentar os 24 textos hoje e por isso como João falou fou não a gente não pretende receber contribuições nessa audiência pública porque são vários métodos diferentes e formulários diferentes de contribuição então a ideia hoje é que cada um tire todas
suas dúvidas sobre todos esses documentos e as contribuições sejam feitas na nos formulários que estão disponíveis para cada uma das consultas públicas porque tem RDC tem in tem o o o edital de chamamento como João falou na notícia que foi publicada Sobre a audiência pública você tem link já mostrando essa daqui é sobre isso entre no link tal e o prazo é tal Porque Lembrando que são três datas diferentes né o edital de chamamento público ele tem um mandamento mais rápido depois de aprovado Então acho que o edital é no dia 4 de março as
consultas públicas 1290 91 e 92 se encerram no dia 5 e o a 1293 no dia 13 de Março então na notícia Já tem todas essas informações para que ninguém esteja perdido com base nisso tudo pra gente foi difícil andar com 24 consultas públicas né 24 documentos a gente sofreu passou por várias coisas até a mudança do pro Anvisa leges a gente já tinha todos os documentos prontos no portal antigo teve transformar tudo para uma Visa leges Então gostaria de começar agradecendo o pessoal da cpro que é a área de regulação né que trabalho com
as consultas públicas que nos ajudou demais a conseguir colocar à disposição todos esses textos com diferentes mecanismos agradecemos a nossa diretoria também que deu todo apoio trabalhou com a gente na aprovação das consultas públicas e agora o Christian toda a equipe da cevec que fez tudo aqui paraa organização do nosso evento Então como são muitas coisas a gente vai ter uma programação para vocês entenderem como é que vai funcionar então deu uma introdução Zinha sobre o processo da construção normativa falando muito rapidamente sobre o air é só para explicar para vocês essa TV não tá
funcionando então vou ter que ficar olhando para cá de vez em quando tá eh a revisão da RDC 26 e o guia passando muito rapidamente por cima do guia já que ele não tá em consulta pública ainda o guia Ele só pode entrar em consulta pública já em vigência então ele vai entrar em consulta pública tão logo alterada a norma de registro E aí a partir disso a gente faz um intervalo para tirar todas as dúvidas relacionadas à Norma principal tá faz todo o debate depois desse debate tem 10 minutos de intervalo e volta com
as IES relacionadas o registro simplificado e as antigas Os anexos da RDC 26 que viraram em e por fim só onde obter mais informações que a gente vê que tem muita gente ainda que não entende bem qual é a diferença então tem todos os documentos onde eles estão e onde podem ser obtidas mais informações é preciso que todo mundo pare e leia esses documentos eh se você for passar por cima tem cerca de 2.000 páginas de documentos disponibilizados com essa mudança porque tem as os as monografias e os relatórios de avaliação do registro simplificado Então
são muitos documentos que é preciso parar preciso entender tudo eles mas tá tudo escrito não tem algumas pessoas disz não eu não participei desse processo de construção el não precisa ter participado para contribuir porque está tudo no air está tudo no guia tudo que a gente conseguiu juntar desses 12 anos de discussão estão lá no air tanto que eu acho que é o maior irir da Anvisa tem 800 páginas porque são 888 páginas Exatamente porque tem todo o anexo dessa discussão né a gente tentou resgatar tudo porque muitas vezes a gente sofre tenta trabalhar com
a consulta pública depois vem assim V republicou mais uma Norma para que fiz eram isso então é para deixar claro porque que isso precisou ser feito de onde veio essa demanda tá tudo ali então é só para vocês lerem porque hoje tá tudo realmente disponível deu trabalho brinco que se a gente não tivesse fazer o air de fito e de cannabis a gente não teria fila que vocês não tem noção que é fazer uma análise de impacto regulatório é pior do que um um doutorado Então hoje nós temos a intenção de discutir todos esses textos
apresentando esses textos e tirando as dúvidas de todos para que as contribuições sejam um a melhor forma possível da nossa parte a gente já evoluiu eh dentro do arcabouço legislativo brasileiro em tudo que a gente poderia onde a gente enxergava que a gente conseguiria evoluir a gente evoluiu e agora a gente pede que todo mundo que agora tem um olhar mais amplo outras pessoas estão vendo contribuam para que realmente esses texos saiam da melhor forma possível então hoje vamos discutir a consulta pública 1290 1291 92 93 o a o guia o edital de chamamento público
e todos os textos por cima também da doos textos técnicos que estão sendo discutidos por meio do edital de chamamento público número 13 de 2024 esse negócinho não ajuda não então esse slide quem vê nossas apresentações já sabe decorado Mas é uma coisa que muitas pessoas não entendem o sofrimento que é eu tô tentando passar o sofrimento que é regulamentar fito no Brasil porque às vezes a gente quer abrir as coisas quer fazer um pouco diferente mas no Brasil fitoterápico é medicamento conforme a legislação sanitária a 6360 a 5991 a 6437 e todos os requisitos
de qualidade e segurança eficácia estão estabelecidos em lei eu não posso autorizar um produto que não tenha garantida a sua qualidade segurança eficácia então não tem como mudar muito é diferente do Japão dos Estados Unidos do Canadá que tem outras categorias nós não temos conforme o nosso código penal qualquer produto que temha indicação terapêutica ele tem que tá regulamentado pela Anvisa juntando com a 5991 ele tem que est regulamentado como medicamento e a 6360 traz todos os requisitos para medicamento então não tem muito como abrir como é nos Estados Unidos chamar isso de suplemento e
e e e fazer coisas diferentes então a gente está abarcado por esse essas previsões normativas que impedem algumas alterações Então essa é a definição de medicamento Ela é bem Ampla qualquer produto que tenha uma indicação terapêutica tem que estar regulamentado é da 3 5991 então nós temos por exemplo boas práticas de fabricação que são iguais a qualquer outro medicamento o medicamento sintético vai seguir as mesmas regras adicionadas da in específica de fito então eu sigo tudo porque eu tenho que seguir para registrar o medicamento e ainda regras adicionais adicionalmente a Anvisa entendida como uma agência
de excelência ela faz parte dos principais fóruns internacionais de discussão de medicamentos então nós fazemos parte do pix não só desses dois n do pix do I da OMS mas esses são os que mais impactam na nossa legislação por exemplo toda a legislação de boas práticas clínicas se eu vou registrar o medicamento fitoterápico ela é seguida a partir do iich então é o mesmo desenvolvimento de um estudo que você vai fazer para um medicamento sintético para uma vacina eu tenho que ter todo esse processo com algumas facilitações né que a própria UMS publicou para fitoterápicos
E também temos o i que tem várias normas que são harmonizadas como boas práticas de fabricação de insumos boas práticas de fabricação de medicamentos então é esse cenário que a gente trabalha são produtos que tem que ter a sua qualidade segurança eficácia garantida com base na nossa legislação Se eu soubesse não tinha mado tanto efeito Mas vai dar certo eh colocar um pouquinho Esse é para ser o resumo do air todinho tá das 888 páginas sobre o meu ponto de vista eh nós temos um país que tem a maior biodiversidade do mundo com pelo menos
52.000 espécies descritas né E temos também um país que é um dos países que mais estuda essas espécies Nós somos o segundo país do mundo que mais publica artigos relacionados a a plantas medicinais a população brasileira também gosta muito de fito apesar de não entender exatamente o que é um fitoterápico ela usa fito como se fosse homeopático ela usa um produto sem registro achando que tem registro tanto que a gente teve que trabalhar nesse sentido também para tentar trabalhar nesses esclarecimentos e temos também um um um um Marc bolso de legisla de políticas públicas que
favorecem e deveriam favorecer essa esse mercado de fitoterápicos que é a política de práticas integrativas e complementares no SUS e a política de plantas medicinais e fitoterápicos que dentre as suas principais atribuições tá o desenvolvimento da cadeia Nacional de plantas medicinais e fitoterápicos temos também né um por outro lado essa é a parte boa e essa parte eu gostaria de deixar bem claro porque a gente às vezes fala isso as pessoas entendem de modo diferente eh essas coisas não estão na mão da an visas são estão na mão de várias outras pessoas a Anvisa é
responsável apenas pela regulamentação só para esclarecer nos 10 anos da política de fito a Anvisa já tinha cumprido todas as suas ações relacionadas à política de plantas medicinais e fitoterápicos e do ponto de vista de registro de medicamentos a legislação evoluiu bastante né tem a gente tirou o slide só porque era muita coisa mas a legislação já evoluiu bastante tanto que a gente tem o maior orgulho nos cursos de de fitoterápicos da UMS o Brasil todo ano é convidado para dar palestra sobre regulação de fito no última Edra Quem apresentou toda a parte de padronização
de fito foi Anvisa também pro mundo todo então a gente é reconhecido nacionalmente e internacionalmente e um ponto que a gente observou de toda essa legislação que ainda poderia ser ajustado como tá lá tudo discutido na ir por isso que é muito importante tem 888 páginas mas é anexo gente o texto mesmo é são 180 então Leiam essas 180 páginas que tem todo esse processo aí como se chegou a esse momento que ok vamos mudar essa parte que é o ponto que ainda poderia estar impactando que é o controle quantitativo dos marcadores e a gente
entende que essa mudança pode favorecer né o aumento do do número de produtos aumento do acesso e toda a cadeia Nacional Pelo menos é isso que a gente escuta do setor produtivo há 20 anos né João sabemos decorado já essa história que o controle de te de fito é bem mais difícil que nos outros países tá tudo lá detalhado no relatório E aí até aí que a gente consegue mudar porque de resto tem um slide aí na frente vocês vão já ver né que é a segurança eficácia é mais simples que a legislação europeia a
gente vai ficar com controle qualidade igual então não tem mais porque dizer que a legislação brasileira é mais difícil e que tem um baixo acesso por causa da legislação Então tudo tá abarcado aí nas políticas públicas de fito né que fizeram com que Anvisa revisasse todas as suas normas tá sofrido E desde 2006 essas discussões vem sendo feitas houve uma deliberação específica da da política de fito para que fossem revisados os requisitos de tradicionalidade e controle de qualidade de fitoterápicos os requisitos de tradicionalidade foram revisados na 26 e agora o controle n já teve revisões
anteriores e agora essa parte quantitativa tá sendo feita Então o que é que já se evoluiu desde 2006 né houve um aumento enorme no registro simplificado mais de 15 vezes o número de espécies que estão no registre simplificado quando não é preciso comprovar segurança eficácia eh o detalhamento do uso tradicional com a criação da classe de produto tradicional fitoterápico a notificação dos produtos tradicionais fitoterápicos com base nos produtos que estão no formulário de fitoterápicos da farmacopeia brasileira que foi uma área que evoluiu muito eh tanto no formulário no memento nas monografias farmacopeicas também relacionado com
essa política a rivian e a thí que são as pessoas mais próximas dessa área na farmacopéia infelizmente não puderam estar aqui hoje porque eles estão na Índia no fórum internacional das farmacopeias mas Mandar abraço para todos a gente trabalhou também na discussão de critérios não clínicos por meio da publicação de um guia específico que ele é bem adequado pro controle de fito mais simples do que o controle dos outros medicamentos detalhamento dos dados clínicos que precisam ser apresentados e dados de Literatura e também o maior controle de identificação da espécie vegetal e controle de contaminantes
a gente não tinha controle de agrotóxicos Não tinha micotoxina eh Essa parte a gente era muito deficitário evoluiu bastante nos últimos anos então fazendo toda essa revisão onde todo esse arcabouo que foi construído em conjunto com o setor produtivo com a academia com várias áreas da Anvisa a gente percebe que tem esses pontos ainda que precisariam ser alterados para ter uma legislação muito boa para fitoterápicos o primeiro ponto é a questão do controle dos marcadores e o segundo ponto é uma alteração no regime simplificado porque ele hoje é muito relacionado aos marcadores sem definir qual
é o insumo ativo específico que deve ser registrado a gente entendia inicialmente que essas alterações poderiam ser feita só no guia na in4 porque as especificações que precisam ser mudadas estão lá e na no na in2 que seria o regime simplificado mas depois de toda a discussão com as associações com todo o histórico que tá lá no air a gente entendeu né E foi pedido que fosse feito um análise de impacto regulatório que as alterações fossem incluídas na Norma principal aos pouquinhos ele passa Então esse guia que a gente discute as principais alterações ele tá
pronto desde 2021 por um pedido das associações a gente Chamou as associações apresentou mas aí foi pedido que fosse feita essa análise de impacto regulatório só para todo mundo ter ideia em média se gasta dois anos com análise de impacto regulatório e ainda tem todas as etapas de aprovação de discussão então agora no final do ano passado a gente conseguiu concluir tudo isso todos esses textos e análise de impacto regulatório e hoje tá tudo aí disponível a gente espera que todo mundo Leia porque todas as dúvidas que a gente já recebeu até agora nos webinários
que a gente fez e tudo tá escrito nesses documentos tá Opa segundo análise de impacto regulatório esse seria o problema regulatório a regulação Sanitária de fito relacionada à fabricação o controle de qualidade de fitoterápicas apresenta dificuldades não proporcionais ao risco considerando um controle quantitativo restritivo que a diferencia dos controles adotados internacionalmente podendo favorecer um baixo risco de produtos no mercado nacional e a dificuldade de seu acesso é um ponto que a gente acha que ainda dá para evoluir tá a o air traz também o objetivo os objetivos específicos Quando eu conseguir eu passo eu não
vou ler só pra gente não perder muito tempo mas tá tudo lá na análise de impacto regulatório que é a objetivo geral modernizar regulações de fitoterápicos industrializados de modo a garantir um tratamento proporcional ao risco e a saúde considerando a natureza dos produtos e aumentar a convergência Internacional e eficiência de atuação da Anvisa Lembrando que as mudanças que estão propostas aqui Elas já foram inseridas na farmacopeia brasileira desde 2017 no quinto suplemento então é uma alteração que ela precisa vir para as normas de registro né então por isso que de início a gente achava que
nem precisaria ser feito uma análise de impacto regulatório e alterada a resolução de registro então depois de todas as discussões do air Esse foi a alternativa pontuada como a melhor com menos impactos para todos os envolvidos ela não é a melhor alternativa mas é a alternativa mais viável para esse momento né que seria a revisão da regulamentação incluindo a 26 e a in4 complementada com ações e materiais de educação para que as empresas né porque foi decidido que não será obrigatório a adequação de todos os produtos autorizados Mas para que as empresas entendam que o
novo modelo é bem mais simples e que adiram mesmo que isso não seja obrigatório então nós estamos em todo esse processo regulatório que é muito longo chegamos agora no momento das consultas públicas que é o momento que todo mundo contribui por favor contribuam todas as contribuições que foram Tecnicamente embasadas Elas serão aceitas é nosso objetivo simplificar a gente não tá mais falando tá escrito tá aprovado pela diretoria a gente tá aqui para simplificar para ajustar para corrigir o que tá correto mas a gente precisa que as solicitações sejam embasadas técnicamente não é ó só muda
isso porque eu não gosto ou porque não cabe no mercado brasileiro não eu preciso dizer não cabe por o que é que o que é que Embasa essa decisão porque todas as decisões da Anvisa no processo regulatório precisam ser embasadas então por favor contribuam vi isso pra gente ajudar e publicar essas normas o melhor possível e obrigado então só para todo mundo entender muito rapidamente Qual é a mudança proposta resumidamente é só isso é que os produtos Sigam as especificações previstas nas farmacopeas internacionais reconhecidas Ah é esse é o quadro então excluindo esse quadro da
in4 Teoricamente o problema taria tudo resolvido em que ele determina variações pros marcadores quando eles são analíticos ou quando eles são ativos e eh por mais que esse valor já aumentou bastante nas últimas discussões ele é entendido ainda não apropriado porque a maioria das espécies é tida como extratos tipo outros em que tem um um valor de variação de de marcadores ainda mais amplo do que isso aí e a gente vai discutir isso depois é Esse é o modo que o Brasil regula né é assim porque eu aprendi na faculdade desde que eu cheguei na
Anvisa eu fui treinada a entender um fitoterápico assim Gente do céu esse aqui tá pior me deixa os dois que eu aperto os dois uma vez só para ver se algum funciona não passa não vocês estão ouvindo Quem tá aqui perto tá ouvindo minha agonia pronto eh o fitoterápico é entendido como um fitocomplexo é um conjunto de muitas substâncias você tem 400 a duas 1 substâncias ativas fora todas as outras não ativas Então não é possível Tecnicamente não é o birajara você tá por aí querer não é possível Tecnicamente dosar essas 400 ou 2000 substâncias
e por conta disso se escolhe substâncias específicas prole de qualidade essas substâncias hoje na nossa legislação são chamadas substâncias marcadores e são feitos ajustes a essas substâncias Independente se essa substância está ou não relacionado com a atividade terapêutica ó eu posso ir dizendo passa e vocês passam pronto qual é a diferença principal né isso vem lá da legislação europeia tá escrito na farmacopeia europeia eh separar o controle dependendo se essa substância que é escolhida por controle de qualidade tem ou não tem demonstrada a relação com atividade terapêutica então quando eu demonstro que essa substância selecionada
por controle ela tem o mesmo efeito do extrato como todo essa substância é entendida como uma substância terapeuticamente ativa e eu posso fazer todos os ajustes para ter um valor exato dessa substância então só nesse caso que são pouquíssimos extratos é que eu faço ajustes para ter um valor exato dessa substância que é entendida como substância responsável pela atividade terapêutica e o estrato como todo é entendido como um exato padronizado eu tenho ainda casos em que não foi demonstrado que essa substância é totalmente sozinha ou esse conjunto de substâncias são são responsáveis pela atividade terapêutica
e aí nesses casos eles têm uma relação mas ele não tem o mesmo efeito do extrato como todo esses agora foi pior esses estratos nesse caso aí a substância é entendida como marcador mas é um marcador ativo e eu posso fazer pequenos ajustes porque isso é dado como controle como uma faixa é um pequeno grupo de substância também né é um pequeno grupo de substâncias também que variam ali dentro daquela faixa que são feitos pequenos ajustes porque eu não tenho mais uma substância única responsável pela atividade terapêutica por fim você tem o que é a
maioria das espécies a todas as plantas medicinais brasileiras em que eu não tenho ainda demonstrado que aquela substância selecionada por controle de qualidade ela é a responsável pela atividade terapêutica do mesmo modo que todo estrato E aí nesse caso ela é um marcador analítico e o trata tido como outros e é para esse caso que engloba 95% das espécies vegetais e que eu vou ter um controle mais amplo que aquele controle entendido como mínimo D eu tenho que ter todas as especificações Mas é uma especificação bem mais Ampla relacionada com o método que foi validado
aí pro controle você me diz aí qual é o próximo slide a gente terminou 11 horas da noite então não decorei a ordem essas definições como eu comentei já estão na farmacopéia brasileira no irir vocês vão ver toda essa discussão teve consulta pública específica para dizer isso olha o Brasil vai mudar para isso aqui porque a farmacopa brasileira ela é obrigatória no registro de medicamentos pela 6360 pela 6437 pela 5991 então houve uma consulta pública específica só para dizer nós vamos mudar o controle de fito disso para isso além de outras consultas públicas e não
houve nenhum posicionamento contrário e esses termos já estão incluídos na farmacopeia brasileira que são os extratos padronizados quantificados e outros passa por favor aqui não passa não Vocês conseguem passar daí é esse agora né Tá certo volta um Deixa Eu abrindo pronto passa mais um por favor aí é só para mostrar todo o histórico na farmacopeia tanto que no no air tem um item que é da evolução do histórico e tudo a gente fez um item só para mostrar como isso evoluiu na farmacopa porque Precisava mudar antes na farmacopa para poder ser mudado nas normas
de registro passa mais uma por favor aí são as definições que já estão lá na sétima Edição mais um e esse é aquele slide que eu tinha comentado se a gente tem agora uma segurança eficácia mais simples que a legislação europeia a gente tem a notificação a gente tem o registo simplificado Mais amplo a gente tem requisitos de segurança eficácia mais simples e agora a gente vai ter um controle de qualidade igual Então pelo menos não se pode mais imputar a legislação o o baixo número de produtos porque o que a gente vê é que
tem muitos problemas para que a cadeia de fitoterápicos se desenvolva no Brasil mas toda a culpa é jogada só na legislação a gente nunca vê olha ninguém tá vendo que as pesquisas não são focadas num insum ativo específico ninguém tá vendo quanto não tá sendo investido em Novos Produtos ninguém tá vendo a gente só teve quatro estudos clínicos com fito nos últimos 5 anos é menos de um estudo aprovado pela Anvisa nos últimos anos mas não todo mundo que vai para os eventos faz olha a legislação S acaba com os fitoterápicos no Brasil gente do
que dava para ajudar do que dava para organizar Até agora está sendo feito nessa mudança é preciso que todos os outros fatores também contribuam mas a gente vai ver lá no registro simplificado que na verdade a gente não consegue dados para nenhuma planta brasileira seguir todos os requisitos seja de tradicionalidade seja de estudos clínicos porque as pesquisas são muito desfocadas eu tenho um dado sobre os trato etanólico da raiz o outro é sobre strato acoso da folha eu nunca tenho todos os dados completos para o meso informativo de plantas medicinais especialmente as plantas medicinais brasileiras
por isso que muitas vezes se dizia ah Anvisa só privilegia as plantas eh europeias mas para por exemplo um exemplo que a gente dá sempre em relação ao guaco eu não tenho um estudo Clínico do guaco nem com adulto muito menos infantil predera ELX eu tenho 10 estudos clínicos com a Facha etária infantil mostrando todos os efeitos adversos todas as interações tudo isso tá bem detalhado e a gente precisa que tudo isso evolua no Brasil ainda para que se tenha 10.000 produtos como tem na na na Alemanha 3.000 produtos como tem no Reino Unido e
tudo mais da nossa parte a gente tá andando é preciso que todo mundo anda em conjunto O Rafael tá aqui seja muito bem-vindo do Ministério da Saúde o ministério tá trabalhando muito nessa parte das monografias do ren SUS né foram selecionadas as plantas de interesse paraos SUS e a partir disso fazendo monografias para ver exatamente o que já tem o que é que está faltando para cada uma dessas espécies elas também passam por consulta pública estão em consulta pública agora e é muito importante você bom também então vamos passar rapidinho pela revisão da RDC 26
esse slide lá do webinar que a gente fez em 2011 vocês verem que tá tudo público disponível aí já faz tempo então Eh isso começou com a solicitação do setor começou com a bfis depois se integraram a bifina e sindusfarma e foram entrando várias outras associações desde 2011 solicitando essa alteração na época o diretor Presidente deu se meses para as associações chegarem com o guia pronto que aquele guia lá EA se o de registro eh a gente não conseguiu fechar essa discussão desde aquele tempo ela veio evoluindo eh já foi discutido por meio de muitas
reuniões como vocês podem ver no air com todas as 10 associações do setor regulado com todos os professores que trabalham com a gente junto à academia nós temos várias comissões na farmacopeia na Anvisa que participaram de todas essas discussões eh tudo isso tá discutido lá no air no webinar os novos conceitos já foram incluídos em várias normas da Anvisa como a n130 farmacopéia o memento então a gente precisa agora só trazer esses conceitos para RDC 26 né paraa nova RDC 26 então aqui tá um pouquinho do histórico como eu comentei começou com o pedido da
bfis depois entraram al lanak sindusfarma e aos pouquinhos foram entrando outras associações nessas discussões nós fizemos várias reuniões principalmente lá em 2013 2014 na época da 26 e depois momentaneamente voltam várias discussões sobre isso então é um longo processo de discussão porque porque como eu comentei o Brasil entendia que tinha que controlar fitoterápicos assim as pessoas tiveram que abrir a cabeça e entender que existem outros modos de controlar fito que esses modos podem ser mais adequados do que aquilo que a gente se acostumou que era uma simplificação era tratar um fito como um medicamento sintético
e não é a melhor forma como a gente tem uma equipe reduzidíssima gente nossa equipe somos nós a Raquelzinha e o i por enquanto e tem mais algumas pessoas que não não estão aqui mas é basicamente nós não temos mais que 10 pessoas para fazer tudo técnicos especialistas E aí a gente contratou alguém para fazer essas revisões lá no ano de 2010 né foram 2009 foram contratados especialistas que iriam revisar o guia mas cai a mesmo tempo da pandemia eles não conseguiram entregar o guia técnico e encaram só o guia Popular que foi publicado em
2000 e você lembra 2021 foi 22 logo depois que ocorreram aquelas duas mortes com o uso de fitoterapi ir regulares então foi publicado 23 o Jão que sabe das datas gente eu sei nada de data Eles foram publicados para tentar esclarecer a população toda essa parte aí do do do que é um fito regular o que não é um fito regular depois disso né a gente houve mais um pedido da bfis a gente elaborou todo o guia chamou todas as associações para discutir E aí foi pedido a realização da análise de impacto regulatório que só
terminou todas as suas aprovações no ano passado e por fim foram propostas as consultas públicas que estão aí agora paraa discussão de todos ó tá funcionando Então esse é o a página das consultas públicas no avisa leges tem muitos documentos que estão lá todas essas 2000 páginas estão lá disponíveis Tem o voto da diretoria tem toda a parte do da aprovação o formulário de abertura de processo o guia o relatório de análise de impacto regulatório então tem muita coisa lá não Ava leg a gente pede que vocês Leiam por favor deu muito trabalho de escrever
tudo isso buscar tudo isso e o que a gente vê é que olha a gente perde muito tempo respondendo site documentos e reuniões a maioria dessas coisas estão todas escritas nesses documentos então é muito importante que vocês Leiam tudo isso quer saber todo o histórico de Fit pelo menos nessa parte de te tá aí como a gente não tem tempo de discutir tudo Bora focar no que mudou tá Então aqui estão listados todos os pontos da RDC 26 que estão sendo propostas as mudanças e tá como é pouco tempo tá chamando atenção exatamente pro ponto
que foi modificado primeiro ponto é no objetivo da RDC 26 eh foi publicada a RDC 948 de 2024 que é a norma geral que dispõe sobre os requisitos sanitários para regularização de medicamentos de uso humano Então a partir de agora a norma de registro ela é complementar a essa Norma geral eh na abrangência da RDC 26 vocês desculpem eu vou ter que ficar mais assim eu não consigo enxergar dali O que foi incluído foi o a definição que tem na RDC 948 de dados técnicos-científicos então a gente teve que incorporar já tava tudo pronto mas
trouxe para cá As definições que estavam na Norma geral então tem aqui definição de dados técnicos científicos e essa parte aqui debaixo da definição de ptf que eles são caracterizados pela Constância da sua qualidade é só porque tinha faltado na 26 fica parecendo que a Constância da qualidade era só nos medicamentos fitoterápicos Então é só uma correção simples uma coisa que a gente inseriu para harmonizar com a Comunidade Europeia foi incluir os linens que não tinha na rc26 era só fungo e algas então estão incluídos também os liquens para que abarque outros produtos que não
tenham normas específicas e a definição é essa aqui que tá lá na consulta Pública São comunidade simbiótica de fungo de um fungo e uma água verde ou mais raramente Verde amarelada ou marrom ou uma cianobactéria que pode produzir alimento para o linken a partir da luz solar a gente não é especialista nós não temos botânica nossa equipe nós não temos especialistas nesse sentido Então se vocês quiserem contribuir com essas definições por favor contribu Boom também e aqui tá uma das mudanças principais é a questão do que era a droga vegetal e o que era o
derivado Lembra nton Você perguntava que te precisava ajustar agora a gente tá ajustando então a droga é aquela substância que não tá ainda preparada para ser considerado ins sumativo ela não foi totalmente processada enquanto o derivado ele já tá processado ele já é o IFA a ser adicionado no medicamento a gente tentou deixar isso mais claro possível porque essa é a diferença principal não faz diferença nos extratos o extrato fica do mesmo jeito mas a droga vegetal antiga ela hoje pode ser considerada o derivado tá vou correr tá aí no guia Mas o problema do
apontador viu eu falo rápido tá tudo detalhado no guia como vocês vir aqui agora tá funcionando Vai mais rápido alterações nas definições só para vocês virem foi incluída a definição de constituintes com atividade terapêutica e a definição de marcador foi ajustado ao que tá na farmac foi alterado a definição de perfil cromatográfico incluindo né A questão do controle também da demonstração da qualidade no estudo de estabilidade e foi detalhada a questão dos quimiotipos variedades e morfotipos que a gente não tinha antes mas que vem com força aí com a cannabis lembrando essas alterações todas se
aplicam também pros produtos de cannabis no controle de qualidade os que sejam extratos vegetais então aqui são as definições de extratos que já estão na farmacopeia brasileira não tem nenhuma alteração tá exatamente igual a pharmacopia pé os dados técnicos científicos é o que vem lá da 948 e a definição de literatura científica antes a gente tinha uma outra definição essas definições agora precisaram ser incorporadas eu não vou ler pelo tempo mas se vocês quiserem nas perguntas vocês podem voltar e uma outra mudança é que a gente tinha o mesmo processo para diferentes formas farmacêuticas Então
por harmonização com as outras categorias vai ser um processo por forma farmacêutica agora mudamos agora paraa parte da documentação as mudanças principais são as documentações referentes a boas práticas agrícolas né que não eram solicitadas na na legislação boas práticas de processamento e armazenamento conforme a OMS e boas práticas de fabricação de insuma medicamentos e o o fabricante do medicamento ele tem que apresentar uma declaração sobre a qualidade do insumo isso vem bastante lá das pics do da Europa e também da OMS e todo de organismos geneticamente modificados que a gente não tinha também então Tá
previsto a partir de agora informações sobre o desenvolvimento da formulação que vem da legislação de medicamentos sintéticos a gente não tinha dados de desenvolvimento orientações quando a produção do fitoterápico em mais de um local de fabricação e também com relação à equivalência de insumos ativos e aí o guia vem detalhando todos esses pontos então por isso que é importante ler o guia em conjunto com as consultas públicas e por isso que foi disponibilizado a minuta no relatório de produção eh foi solicitado detalhamento sobre o nome e responsabilidade de todos os laboratórios que por mais que
isso seja Claro a gente não recebe essas informações o controle das etapas críticas metodologia do controle processo orientações sobre tamanho do lote e o quadro que vem lá da Norma de sintéticos detalhando todo o a produção do fitoterápico que é um anexo da RDC 26 no controle de qualidade mudou principalmente a questão de outros contaminantes né quando eles sejam relevantes descritos na literatura técnico-científica porque a norma anterior era uma lista fechada a gente às vezes precisava Como foi o ascaridol no boldo alguma empresa respondia Olha não tem previsão normativa então a previsão está aí se
é um um contaminante importante ele precisa ser controlar quando isso foi importante na literatura técnico-científica e foi detalhada também a frase sobre o o o a regulamentação de agrotóxicos que não era muito a gente não gostava muito daquela frase na preparação vegetal a gente tentou detalhar as informações sobre o método de obtenção da preparação porque não tinha essas informações detalhadas e pro produto acabado devem ser apresentados os resultados para dois lotes e foi incluído o teor de etanol porque não tinha esse controle a gente tem um colega que não Visa que fez uma dissertação sobre
etanol mostrando que é um problema gravíssimo a quantidade de etanol em fitoterápicos principalmente público infantil isso tá sendo feito em conjunto com a farmacopéia também vai ser incluído lá também no relatório de segurança eficácia foram só detalhadas algumas informações não mudou basicamente porque as mudanças principais são no controle de qualidade as mudanças relacionadas aqui estão mais relacionadas com a 948 que precisaram ser implementadas Então vem trazendo aqui o conceito do dados técnicos científicos as novas Ines né ela anexos da 26 elas passam a ser in e quando não tiver dados nas referidas IES os dados
que estão disponíveis na literatura técnico-científica também foi detalhado o método de busca dessas informações na literatura padronizando lá no guia como essas informações devem ser apresentadas que vem lá da legislação de alimentos a gente participou de toda a discussão de alimentos e trouxe essas essas quadros detalhados para cá probióticos e e todos os novos insumos aí eh um detalhamento em relação ao registo simplificado que antes o brasileiro era superior ele era prioritário em relação ao europeu agora eles vão estar harmonizados então não existe mais prioridade eu posso seguir uma lista ou outra a necessidade de
discussão da avaliação benefício risco que vem da 948 e que devem ser incluídos todos os dados favoráveis e desfavoráveis Então essas alterações foram muito relacionadas com a 948 não eram previsões iniciais dessa discussão no relatório de segurança eficácia pro ptf foi detalhado que deve ser apresentado um relatório porque a norma anterior só dizia que apresente as liter aturas ela não dizia que tinha um relatório explicando tudo que tá colocado ali e pra notificação ela ficou mais claro que todos os produtos que estão no formulário que estão na farmacopeia eles devem ser notificados uma outra alteração
que foi pensada foi que a gente tinha os folhetos informativos pro produto tradicional fitoterápico a gente não vai ter mais então todos passarão a ter bula Se quiserem a gente discute depois isso melhor só por conta do tempo e também pros materiais informativos é que são detalhadas os tipos de informações que são dadas paraos estratos padronizados quantificados e outros que tá tudo lá detalhado no guia nas Exposições finais e transitórias tem toda a questão das adequações o que é que precisa ser feito para implementação dessa norma e coisas que precisaram ser trazidas da 26 como
isso aqui que é o prazo para quem ficou como medicamento fitoterápico sem ser toda comprovação de segurança eficácia e aí esse foi um pedido do setor também bastante que a gente recebeu que a partir da publicação da Norma todas as petições serão analisadas conforme a legislação que era vigente na época do protocolo Mas se a empresa Pretender ela informa e poderá ser avaliado conforme essa Norma nova agora tá bom demais ó funcionando tudo esses são os prazos que a gente discutiu bastante também de adequação para produtos que estão em desenvolvimento sejam registrados ou notificados e
a proposta que pros em desenvolvimento que vão a ser registrados eles têm um prazo de 3 anos se eles quiserem continuar mantendo conforme a RDC 26 já os notificados que é bem mais simples Eles teriam um prazo de 2 anos Lembrando que tudo isso tá aberto a discussões eh a previsão de que todos os produtos por mais que não tenham que ser redesenvolvimento da procuradoria para não precisar adequar todos os produtos por completo mas pelo menos as informações sobre esses produtos deveriam ser adequadas e Isso vai ser feito por meio de notificação e o prazo
que isso deve estar disponível pra população e uma outra orientação que a gente recebeu da procuradoria quando foi discutido a não necessidade de adequação de todos os produtos esse conceito eh esse novo conceito de controle é que precisaria haver uma diferenciação entre os produtos eh a gente teve reuniões específicas com o setor produtivo para tentar construir como é que seria feito essa essa diferenciação Mas a gente não recebeu nenhuma proposta né a gente insistia não recebeu nenhuma proposta a gente resgatou isso aí que foi um distribuição na consulta pública da RDC 26 que seria uma
proposta de uma tajaja verde pro fito para aqueles que fossem registrados né os novos que sejam registrados já conforme essas novas normas aí é só dizendo como é que seria a tarem foi incluído também para ficar mais claro essa questão que espécies vegetais que estejam em risco de extinção elas não podem ser utilizadas por meio de coleta apenas se cultivadas seguindo as determinações do Ministério do meio ambiente e algumas previsões de alterações em outras normas para que essas mudanças todas pudessem acontecer então na 708 foi incluída a questão de equivalência de extratos para alteração inclusão
de fabricante de matéria prima vegetal e inclusão de nova concentração para um produto de registrado na mesma forma farmacêutica indicação terapêutica e foram excluídos os artigos 100 e 101 que é de inclusão de nova forma farmacêutica porque agora cada processo vai ser por forma farmacêutica na 47 foram feitas alterações para incluir o ptf porque ela é prévia a RDC 26 então precisar ter uma previsão ali do ptf e também a questão de que tá já na Norma de dcb de cultivares quimiotipos e variedades e só para fechar acho que esse é o último dessa parte
Lembrando que a gente tinha as bulas padrão vai acabar com essas bulas padrão né com a revisão das normas elas deixam de existir porque o registo simplificado agora segue todas as monografias do Ema ou da in2 nova é isso a gente para esses são os pontos principais da RDC 26 a gente vai parar porque a gente imaginou que ficaria muito confuso se o debate fosse de todas juntos vai abrir agora pro debate da 26 como João comentou esse debate é prioritariamente oral por ordem de inscrições aqui na mesa vocês vão até o púlpito com 3
minutos para cada pessoa e se alguém tiver alguma dificuldade de vir até o púlpito a gente disponibilizou esse q code aí que vai se fazer uma contribuição por escrita que a gente vai ler aqui vai identificar a pessoa do mesmo jeito ela só não vai precisar ir até o público mas a gente a gente pede que se possível todos façam contribuições orais né dúvidas sugestões o que vocês acharam por favor fiqu à vontade Obrigada isso pessoal reforço aí a importância de vocês fazerem as manifestações aqui no púlpito considerando que o evento tá sendo gravado E
aí enquanto vocês vão providenciando aí as inscrições para as manifestações eu queria agradecer aqui a presença de algumas autoridades a presença do Dr Rafael polone que é o Coordenador Geral da assistência farmacêutica básica do Ministério da Saúde da Helen também que tá com ele eles trabalham hoje junto da política nacional de e plantas medicinais e fitoterápicos Eh quero agradecer a presença da Dra Maria berrens também representante da Fiocruz e do professor Leandro Medeiros Priscila dejus nton luz a Eline Batista e a Denise coutin também representando o Conselho Federal de farmácia que estão aqui hoje participando
também na nossa discussão Muito obrigado pela presença Bom dia eh a primeira pra primeira manifestação a gente convida a Rosana mastelaro do sindos Farma [Música] Bom dia a todos Acho que vocês não estão me ouvindo né mas eu liguei aqui agora sim né Tudo bem Ana foi difícil te acompanhar você acelerou lá no final mas é primeiro ponto hein eh então Eh Obrigada essa oportunidade é ótima a gente leu o tempo foi curto 888 páginas 2000 documentos mas Graças aos especialistas que a gente tem alguma coisa a gente já absorveu eu queria focar só nos
pontos macros assim que seriam Como contribuição que é claro que depois a gente vai mandar no tempo e as coisas mais específicas né Eu acho que a gente tem especialistas muito melhor do que eu para citar Ana ficou uma grande dúvida Ana né João G mesp Raquel ficou uma grande dúvida para nós se era a obrigatoriedade do legado ou não eu tô entendendo que no mínimo em termos de questão de Bula rotulagem ele tem que se adequar É isso mesmo e aí eh eu acho que esse foi um ponto assim muito importante porque todo mundo
leu a ir entendeu que o legado não teria que passar por tudo isso mas depois quando a gente discutiu então gerou um grande ruído eu acho que tem que ser muito claro eh isso eh para que todos tenham eh eh evidência disso porque isso pode dar eh como é que fala um impacto maior paraas empresas né tanto a diferenciação depois com a targe ou não e a gente manda depois eh ficou muito claro que vocês alinharam com a com a 948 E aí a gente vai mandar com uma sugestão eh eu acho que a gente
deveria diferenciar o dossiê técnico do produto do relatório técnico do produto Tem coisa que são itens de documentos a também algumas sugestões no sentido de ser mais detalhado no guia a norma poderia ser um pouco mais enxuta tá a gente também percebeu isso e a gente pode mandar e eu acho que isso fica em linha lá com a 948 também tá eh chamou muita atenção laudo de controle de qualidade só dois lotes achamos diferente a gente nunca soube porque três mas também quando vocês surpreendem a gente com dois a gente também fica com dúvida a
questão das informações agronômicas eh se depois vocês puderem até detalhar um pouco mais pontos bem sensíveis tá eh eu acho que sensíveis pra gente entender e alinhar as expectativas com a agência a questão de compatibilidade do IFA ver com incipientes e aquele resíduo dissolventes do álcool né Principalmente do álcool a gente tá falando por isso emb bua rotulagem talvez Ana a gente Dev se dedicar um pouquinho mais para essas discussões e até envolver outros especialistas estabilidade ficou dúvida se é só produto acabado na Norma só fala de produto acabado não sei se sem querer faltou
lá o pós-registro aumento de 10 vezes implementação imediata a gente percebeu ou então a gente não entendeu também na questão de alinhar a expectativa eh mas agora eu entendi que só ente se a monografia especificar claramente a questão de nitrosaminas e alcaloides pirasol é isso mesmo né então vocês não querem essa discussão é somente se ela acontece na monografia lembrem que eu não sou especialista tá gente posso estar falando bobagem mas eu não sei se agora quando você falou se eu entendi melhor tudo que se refere a agrotóxico a gente acha bom detalhar mais na
CP específica só ter a citação na Norma mãe associação deixar um pouco mas claro a possibilidade de associar diferentes eh produtos tá porque senão dá uma sensação de que não pode e parece que no guia discute a gente vai mandar isso também como contribuição Mas se vocês puderem citar você já falou de um que era monografia segue a ema o controle de qualidade não necessariamente mas isso tem o vínculo com o legado também podemos né e por último alinhamento na questão tanto de frases que a gente tá aprendendo muito com o GT de revisão da
768 a gente viu então por isso que eu destaco muito essa questão de álcool causou grande preocupação não só eh constar numa rotulagem mas também a forma como vocês pedem para ser avaliado eu não sei se a gente tem dados suficientes para fazer dessa maneira Talvez uma outra discussão então tem alguns para ser rápido alguns que também a gente como sempre tá disposição Ah faltou um eh sugeriram uma mudança do constituinte com ativid idade terapêutica em alinhamento com a Ema ser constituinte ativo não sei se isso chegou para vocês parece que eles tratam com essa
terminologia como a gente pede Vamos mandar tudo isso tá detalhadamente mas antecipar aqui o que a gente recebeu e com atenção principalmente para esses pontos que não ficou muito claro ou pontos que a gente tem receio que depois o grande objetivo é que a gente não Afaste o consumidor do fitoterápico né a Anvisa não é culpada falta fiscalização e punição principalmente mas também a gente tomar cuidado para que o consumidor Não crie nenhuma uma dúvida em relação a aquele produto das empresas devidamente regularizadas nava tá bom muito obrigada convido agora a senora Tatiana Ribeiro do
grupo cento Flora Bom dia a todos Bom dia equipe da gmesp quero parabenizar pelo trabalho a gente sabe o quanto a equipe dedicou e a gente como acredita no fitoterápico no Brasil entende que é um Marco importante que vai acontecer no Brasil eh eu quero aproveitar é somente uma sugestão para reforçar a importância da manutenção dessa declaração solicitada aos detentores do registro ou ainda que seja do fabricante do ifav sobre o ento das boas práticas a gente sabe a importância disso já conversamos em outros momentos né uma vez que o certificado não é um documento
exigido no país que a gente tem essa declaração ainda que fornecida pelo fabricante do ifav nós sabemos que o fabricante do ifv ele é inspecionado à luz da 654 de boas práticas mas que e também que o setor regulado as indústrias farmacêuticas elas qualificam esses fornecedores Então a gente tem um trabalho a quatro mãos sendo feito junto em parceria com a Visa e é importante que a gente Olhe que os fabricantes de fav Nacional eles são eh Os nacionais são inspecionados a lusa 654 mas a gente também tem um mercado importante que é a distribuição
de insumos que não são fabricados no país então esses insumos muitas vezes a fabricação dele é importante que o distribuidor e os distribuidores ainda que seja Um fabricante nacional e também faça distribuição que ele Garanta né por meio de de uma declaração e forneça isso ao detentor do registro sobre a garantia do cumprimento das boas práticas então eu a gente quanto grupo centro Flora eh e também conversando com os associados da abifina a gente entende eh a importância da manutenção desse documento e parabenizar por ali por isso ter sido contemplado obrigada obrigada a todos chamamos
agora a senhora gislan Gutierres da bfis Bom dia antes de mais nada eu queria parabenizar o trabalho da gesp porque a gente sabe E acompanhou durante todo esse tempo que foi um trabalho de muita dedicação foi um trabalho muito longo acho que a gente tá num momento muito marcante pro setor regulado que tem esperado as melhorias né as as a convergência regulatória e a melhoria das tratativas referên ao controle de qualidade e produção dos fitoterápicos eh e o setor a bfis eh Trabalhou muito para que a gente pudesse pensar num cenário mais coerente né e
uma regulamentação também coerente e com isso a gente eh proporcione desenvolvimento do setor de fitoterápicos eu não trouxe aqui eh todas as contribuições que a bfis já discutiu em relação à CP 1290 a Rosana já fez uma lista muito importante que muitas coisas convergem com as nossas mas a gente a gente com certeza vai poder mandar isso para vocês e discutir em tempo oportuno eh mas eu queria trazer um ponto bem importante que eu acho que pode ser o principal também abordado já pelas colegas que que é a questão da manutenção do legado né que
é defendido muito pelo setor regulado e o que nós entendemos é que existe a previsão sim de apenas uma atualização de rotulagem para harmonizar com que já é previsto agora no texto da CPRE pros produtos novos né novos a serem desenvolvidos e o que nós gostaríamos de entender e eventualmente debater com a gmesp é a possibilidade de não apenas a o setor regulado eh atualizar suas rotulagens mas eventualmente de poder atualizar eh especificação para estar coerente com o que já é preconizado então digamos assim se eu tenho um extrato classificado como tipo outros e eu
adeco minha rotulagem para declarar apenas a quantidade do eh do derivado da preparação vegetal que a empresa também tem a possibilidade de adequar sua especificação eh para um teor mínimo eh Essa é só um exemplo ilustrativo né sem mexer na nas características essenciais do produto mas flexibilizando para que a empresa possa eh também fazer essas pequenas adequações para ficar eh convergente com o que é preconizado já no novo texto tá E aí seria eh a manutenção das das características do produto mas com pequenas adaptações para Que Pudesse Conversar com essa questão Já que é a
a o o próprio conceito agora sendo estabelecido tá então eh seria a manutenção do legado com possibilidade de flexibilizar um pouquinho no controle de qualidade e também na produção Se isso for possível então acho que é uma discussão bem importante que o setor tem tem trazido bastante nas nossas reuniões né Eh porque olhar só para rotulagens e não poder flexibilizar também de forma a facilitar algumas questões também práticas né de operações em relação aos produtos bom era isso obrigada acho que a gente vai ter bastante coisa aí para interagir obrigada Oi a gente agradece demais
as contribuições Rosana V logo a porrada né gente eu sou cearense vocês não liguem com as brincadeiras não e eu vou ver tem dois pontos que a gente não entendeu direito mas você qu terminar as discussões quis a gente pede que você volte Rana só para explic esses dois pontos e as normas já estavam prontas esperando todas as aprovações superiores e veio toda a discussão da 94 E aí por conta disso a gente teve que inserir várias coisas aí e e até revogou várias coisas da 26 já então foi uma demanda superior a gente não
teve tempo suficiente para adequar tudo isso mas agora na consulta pública a gente pode realmente ver o que é que pode ser feito seguindo-se essa Norma geral porque ela é obrigatória já tá publicada sobre dossier e relatório técnico do produto isso é tranquilo a gente pode fazer não tem problema nenhum a questão do laudo de dois lotes é porque hoje dois lotes né a gente hoje só pede um E aí para adequar aquele quadro que tem no anexo ele a gente precisaria de pelo menos dois lotes mas a gente já pensou em ver se para
harmonizar com todo mundo pede os três lotes mas basicamente foi para ajustar com o anexo que veio lá da Norma de sintéticos é os três da estabilidade continuam mantidos ali é só quando hoje Pede só um um laudo pr pra droga um lado por derivado um lado para produto acabado Então em vez de ser um só seriam dois mas realmente tem a possib ade de pedir logo três porque ficaria harmonizado com os outros medicamentos pode ficar dois tem vários pontos que a gente tentou ser mais simples e já teve pedidos para ficar mais complexo depois
a Mas é porque lá em sintético tem a justificativa de seus três né Eh sobre as informações agronômicas foi o que exatamente que você é o sobre esse documento de assinatura do laudo de informações agronômicas falar não tem que falar daqui porque tá gravado eh só para esclarecer a gente tá mudando enquanto a Rosana tavina a gente tá mudando de uma legislação que privilegiava o controle dos marcadores não importava como esse extrato era feito desde que o marcador tivesse naquele valor exato com aquela variação tava tudo bem a nova legislação ela não privilegia mais isso
são 5% dos estratos que vai ter o marcado ativo e que vai ter todo esse controle então pro resto todo que é importante é o método de fabricação Então eu tenho que ter todas as informações desde a matériaprima desde o cultivo as boas práticas agrícolas boas práticas de processamento e um processo de fabricação muito bem estabelecido então por isso que tá mais detalhado o laudo agr o laudo de informações agronômicas todo o documento que a gente acha muito importante assinado pelo responsável enquanto não tem o o a obrigatoriedade da certificação mas a gente já teve
pedido de obrigatoriedade de certificação né e gente consulta pública vai ter pedido de todos os jeitos vai ter pedido para subir o nível vai ter pedido para baixar o nível a gente tá discutindo tudo isso e pede que vocês document porque para alterar a gente vai ter que justificar todas essas alterações Ana grande diferença de quando a gente tá aqui primeiro é conseguir entender essa lógica Então faz todo sentido o que você tá falando mas por exemplo a gente recebeu uma na discussão teve um comentário assim ah pode ser aceito eh conforme guia da Ema
eu esqueci aí o nome guria de práticas agronômicas da Ema alguma coisa assim e eu tava agora conversando com a Liliane quando você explicou que vocês se basearam nas normas pix faz todo sentido pra gente A Visa tá dentro da PX o que que o PX recomenda tá bom E aí vem essa pergunta por exemplo as os outros países que também seguem o PX provavelmente eles vão ter documentos equivalentes que é segur em isso é era esse sentido mas que você explicou agora Então na hora que que refleti e eu queria validar se era esse
o entendimento isso desde a publicação da in 138 que é a que complementa a 654 que é específica de boas práticas de fabricação de fito você já tem a exigência do cumprimento das boas práticas agrícolas Então já está previsto em outra Norma a gente só fez pedir pelo menos uma declaração do fabricante do medicamento Ok eu sigo as boas práticas agrícolas porque o Brasil não certifica ainda não tem um documento que certifique tal a centroflora produz conforme as boas práticas agrícolas então a gente pede que o o o a pessoa que vai solicitar o registro
dessa declaração tá continuando eh a compatibilidade de você podia ter ficado aqui Rosana então eu vou falar todos que a gente entendeu os os outros a gente deixa para depois sobre a estabilidade de insumos a gente não tinha previsão de pedir a estabilidade de insumos na Norma de registro Mas ela já é prevista nas normas de bpf e tanto que o guia diz olha não é solicitado no registro Mas ele tem que ser feito até porque eu tenho que estabelecer a data de estabilidade data de reteste ela tem que ser feita com a publicação da
948 agora a gente já tá pensando em não tá na 94 o ela tem que tá aqui também então muito provável na CP final vai sair o pedido de de estabilidade de insumos porque tá na 948 o pós registo e a compatibilidade solvente foi que a gente não entendeu se fica para depois porque as únicas alterações que estão sendo feitas no pós-registro eh incluir a equivalência de extratos quando eu incluo um novo FV e acabar com a questão de incluir uma nova forma farmacêutica nenhuma outra alteração tá sendo feita no P registro nesse momento sobre
novos dominantes eh a gente até escreveu no guia foi a última alteração que a gente fez no guia porque esse guia já estava pronto desde 2021 foi a questão da nitrosaminas teve uma denúncia do Rogério quem teve que tomar conta de todo esse trabalho de um produto nosso da gesp que tinha uma alta contaminação de nitrosaminas essas nitrosaminas Vinham da água não era nem do produto em si era da água utilizada na fabricação foi isso Rogério Uhum E aí a partir disso a gente começou a discutir passou a receber sates então a gente entrou em
contato com todas as autor idades panamericanas porque a gente participa dessas redes hoje e com a a autoridade espanhola alterando autoridade Portuguesa e a alemã E aí eles orientaram que se realmente não tem a previsão na Norma específica e no na no guia de nitrosaminas porque aquela Norma lá é feita para medicamentos sintéticos ela é uma Norma harmonizada literalmente do pix e o pix ich e o i não não regula fitoterapi então é por isso que na Norma de nitrosaminas não tá citado claramente os fitoterapi mas para ficar claro a gente vai incluir na nossa
já tem o item outros contaminantes a gente já cita lá agrotox micotoxinas e nitrosaminas porque é um produto que realmente precisa ser controlado tem vários riscos e a gente traduziu no guia exatamente a orientação que tá na legislação europeia então não tem nada diferente se vocês pegarem o texto da legislação e verem que tá no guia é uma tradução literal alcaloides pirrolizidínicos Eles já estavam no anexo 1 da RDC 26 desde a 2014 não tem nenhuma alteração o texto tá exatamente igual em relação a agrotóxico a única coisa que a gente mudou é porque a
frase que dava na RDC 26 era uma frase que foi prod foi escrita lá na diretoria que a gente não gostava muito que tinha que justificar não não tinha muito assim agora é dizendo Olha só pode utilizar se o agrotóxico for aprovado para aquela cultura no limite que Foi estabelecido para aquela cultura senão essa matéria-prima se passou desse limite ela não deve ser utilizado então foi a mudança básica que teve na CP 1292 não tem um detalhe da análise de agrotox porque ele está na própria 1290 que eu tenho que fazer a análise e a
análise como todos os outros contaminantes é feito conforme a farmacopeia brasileira então aí só a lista de agrotóxicos que precisam ser avaliados paraas culturas produzidas aqui no Brasil por isso que não tem muito detalhe porque o detalhe que A análise deve ser feita tá na própria 1290 que é do registro a questão da possibilidade de associação de diferentes produtos eu até relio o guia todinho ontem eh tem um item específico sobre isso quando é que eu posso E quando é que eu não posso no registro simplificado da lista brasileira não pode para ter registre simplificado
associado tenho que ter a monografia associada nós não temos no registre simplificado brasileiro já no Ema tem Então sempre que tiver uma monografia associado Na Comunidade Europeia ela pode ser utilizada aqui também tem um capítulo do guia que é só sobre associações se vocês acharem qualquer frase que pode ficar mais clara a gente pede que vocês contribuam Pode mandar o muda disso aqui para isso aqui aqui por conta disso tudo a gente vai querer que fique o mais claro possível porque a gente escreveu até onde a gente acha que tava Claro a gente escreveu Jão
revisou a equipe toda revisou então a gente acha que pra gente tá claro mas é muito importante que vocês mostrem O que é que não tá claro e como pode ficar mais claro alinhamentos de frases da GT do GT da 768 eh realmente tem muita coisa acontecendo na VISA que a gente não consegue acompanhar tudo então o que você achar vocês acharem que precisa ser atualizado por favor contribuam na consulta pública e sobre mudar o termo de constituintes com atividade terapêutica para constituintes ativos você falou não tem problema também se for o termo utilizado na
Ema a gente autoriza que qualquer termo que vocês acharem que poem ficar mais claro é esse o momento contribuam que a gente vai aceitar nas consultas públicas eh o único ponto que a gente não tinha entendido Rosana era a compatibilidade solventes que você falou só por cima mas depois quando terminar tudo a gente pede para você voltar a gente falta esse ponto Tá certo até Tatiana muito obrigada também pelas contribuições eh a gente tá discutindo até se seria necessária a certificação porque houve um pedido específico de solicitar certificação em boas práticas de fabricação de insumos
mas aí talvez tenha que ter até uma nova análise de impacto regulatório mas pelo menos a a declaração de que esse insumo foi produzido conforme as boas práticas agrícolas ela tem que ser apresentada a gente acha isso muito importante não só a gente é um dos pontos que a OMS mais bate é isso que o a qualidade do fito tá lá na no matéria prima Inicial muito mais do que na análise do produto final eh Gislene muito obrigada pela contribuição também é só explicar o que que aconteceu quando começou toda essa discussão era a ideia
de Olha nós vamos parar de produzir do modo brasileiro vamos começar a produzir do modo europeu então toda a equipe técnica e todos os nossos gestores todo mundo que participou dessa discussão na Anvisa entendia que todos os produtos A partir dessa mudança precisariam ser adequados tanto que a gente fez várias discussões dis lá no irir nas atas que tinha que adequar E aí durante o a discussão do a foi que as associações chegaram dizendo Olha isso vai ser muito caro eh porque para digamos 50% dos produtos eles vão ter que ter nova validação nova estabilidade
eu vou ter que Red desenvolver alguns produtos Então como tá lá no aer gente uhum por favor vai pegando aqui fica à vontade eh então a gente foi tentar discutir como tá lá discutiu com vá especialistas como que poderia ser possível essa não adequação obrigatória E aí depois de conversar com vários especialistas tá lá controle qualidade conversamos com o Dr barbano conversamos com todo mundo fomos conversar com a procuradoria é Pode ser que isso seja possível tá lá no air Eles colocaram que sim que é possível não ter que ajustar os produtos embasado nas justificativas
que estão lá que geraria um custo muito alto talvez até atrasando as vantagens da da mudança normativa poderia impactar e não aumentar tanto o acesso como a gente queria e que a gente poderia justificar que os Novos Produtos já serão melhores do que já estão hoje autorizados os quais foram autorizados pela normativa vigente então eles disseram que a gente poderia ter a todas essas justicativa para não deixar a adequação obrigatória quando a gente diz adequação é eu ter um produto que hoje é controlado com o valor exato de marcador e que eu misturo o lotes
e que eu faço diluição com recipientes para chegar nesse valor exato marcador isso aí quando passar para novo conceito se ele é um extrato tipo outros ele não vai mais fazer a mistura de lote não vai mais poder fazer a adição de recipiente Então eu preciso mudar o desenvolvimento desse produtos os contoles a estabilidade a validação Então isso é o que não vai precisar ser feito mas a procuradoria foi bem clara que não podem ficar produtos da do mesmo insuma tio com informações diferentes em sua rotulagem no mercado porque eu vou ter um boldo que
é um extrato tipo outros que não vai dizer qual é o marcador e que diz hoje o marcador e os autorizados a partir de agora eles não vão dizer Qual é o tipo marcador eu vou ter uma rotulagem que é de um jeito e eu vou ter rotulagens de outro jeito Isso pode causar uma confusão muito grande no mercado e essa alteração é muito simples é só olha eu sou um extrato outros eu não vou mais dizer o marcador eu vou dizer eu tenho tanto de planta tantos gramas de planta para obter tanto aqui do
meu extrato eu fui obtido com o extrato tal então essa a adequação mais simples que precisará ser feito ninguém vai ter que redesenvolvimento quando eu informo a quantidade de planta quando eu informo a quantidade de marcador é essa alteração que Por orientação da procuradoria ela precisa ser feita eu não tenho como ter o mesmo produto no mercado com informações diferentes porque foram produzidos de forma diferente sobre poder ajustando os produtos eh vocês podem ajustar na hora que quiser nossa intenção que todo mundo ajuste eles os ajustes agora que não vai ter um código de assunto
específicos Eles serão feitos conforme a norma de pós-registro Então como a gente colocou ali quem quiser vai nessa momento inicial vai ser avaliado pela Norma vigente no momento do protocolo ou vocês já podem pedir que seja avaliado conforme a nova Norma ou a parte do controle de qualidade então sim eu posso ajustar concomitantemente mas isso tem que ser feito dentro de se meses porque é o prazo para ajustar a rotulagem quem conseguir fazer isso tem alterações que eu só preciso de protocolo de estabilidade então talvez para essas situações possa ser feito cont comitantemente não existe
nenhum impedimento a gente quer que todo mundo faça a gente o João até fala sempre é não vai ficar obrigatória a adequação mas a gente tem certeza que daqui a poucos anos não vai ter mais esse extrato antigo porque ele é mais caro ele é menos adequado e ele não vai est mais disponível então a gente espera que todo mundo mude E se for agora melhor ainda que seja feito junto à rotulagem não existe nenhum impedimento como PS registro eh antes né quando a a gente fez um um um formulário online para perguntar a todo
mundo prevendo quais seriam as alterações que seriam feitas para as adequações E aí foi respondido que não que não vão ser feitas adequações e a gente conversou até com o pessoal do gegar da da de taxas e tudo e falou já que não tem essas adequações a empresa vai ser não é obrigatório a empresa vai se adequar porque quer ela vai seguir todo a norma de pós-registro não tem código de assunto específico para essas alterações só para notificação de rotulagem bu uhum só complementando Ana eu ia comentar exatamente sobre esse formulário que foi discutido junto
com o setor eh em que a gente passou né tentando mapear as mudanças as alterações O que poderia ser feito para deixar isso mais claro tentar Minimizar possíveis impactos relacionados a isso eh a gente acabou não tendo muito resultado prático que pudesse ser incorporado na Norma naquele momento apesar do esforço que nós todos tivemos E aí eu tô falando do setor também eh mas eh pontos como esse que que gislan trouxe e colocou aqui eu acho que podem ser melhor explorados eu acho que vocês podem tentar explicar melhor isso eh durante as contribuições que foram
feit que forem feitas acho que quando a gente tiver fazendo essa consolidação eh havendo a necessidade e a possibilidade a gente pode chamar para uma discussão eh específica e pontual sobre esses pontos porque a gente consegue visualizar melhor essas mudanças a partir do momento em que a gente eh eh vári várias pessoas juntas começam a discutir esse mesmo ponto e a gente começa de fato visualizar como que eh isso se comportaria em relação aos produtos do legado mesmo então eh a gente tá aberto Desde aquela época a construir como essa mudança pode ser feita de
forma a causar o menor Impacto possível mas deixando isso eh muito claro tanto pro prescritor quanto paciente também em relação ao produto então Eh tentem trazer aí com um exemplo se possível nas contribuições de vocês para que a gente possa amadurecer essa discussão no momento da consolidação complementar só em relação à Tarja Verde a tarja verde é uma proposta que a gente pegou da consulta pública passada se vocês tiverem outras ideias como a gente já tinha pedido para setor você tiver uma outra ideia que talvez cause menos impacto na rotulagem é só contribuir na consulta
pública também mas precisa ser na rotulagem porque a pessoa tem que ver aquela mudança ali antes de comprar o produto não dá para ser na bola porque eu tenho que Teoricamente comprar para abrir e ver a bola surgiram o que vocês acharem mais adequado posso começar a próximo pro próximo bloco de de manifestações convido o representante da lanac Senor Fernando marcu bom dia a todos primeiro lugar queria agradecer a gmesp parabenizar por todo o trabalho n o tempo que demorou até a gente chegar nesses até vocês chegarem a esses documentos compilados para que a gente
possa contribuir claro que a gente teve a oportunidade de participar ao longo do processo mas o o principal o pesado trabalho é de vocês então por isso a gente parabeniza a toda a equipe da gmesp eh queria trazer dois na verdade três pontos o primeiro Ana Cecília já falou eh que o foco desse dessa discussão não é mexer muito nesse momento com o pós-registro mas a gente tem avaliado junto aos nossos Associados na área de medicamentos sintéticos o programa de gerenciamento de mudanças de pós-registro que tem facilitado muito a realização de alterações pós registro e
saber se existe a possibilidade de uma discussão nesse sentido para que a gmesp também possa adotar algo semelhante paraas alterações pós registro de fitoterápicos talvez não nesse momento mas num futuro próximo eh segundo sobre os de adequação de rotulagem a gente primeiro a gente agradece pela questão dos produtos legados sempre foi uma grande preocupação o que seria feito com com os produtos já registrados com os produtos legados e acho que a gente consegue chegar num num termo mais razoável que atenda todo mundo em relação a isso tem a questão da Tarja Verde gerou uma certa
dúvida se os produtos legados quando eles fizerem I ificação de adequação de rotulagem eles também vão precisar então não vão precisar E aí fica a preocupação de como o mercado vai enxergar isso a hora que o hora que o consumidor chegar numa farmácia e tiver um produto da mesma planta mesmo vegetal com um com Tarja verde e outro sem tarja Verde como isso vai ser gerenciado pela gmesp e o a última questão é sobre o prazo de adequação de um ano como a Rosana já falou a gente tá num num GT de da 768 e
claro não tem absolutamente nada decidido em relação aos prazos de adequação mas é algo que está em discussão eh e a gente vê o impacto quando você começa a ter muitas mudanças sucessivas agora a gente já adequa o produto a 768 daqui a um ano a gente adequa a questão de fitoterápicos aí daqui a 2 anos surge uma uma outra necessidade de adequação se a gente consegue equalizar esses prazos para minimizar o trabalho ser feito conseguir fazer todo todas as adequações que precisam ser feitas dentro do mesmo momento Obrigado convido agora a representante da Catarinense
Farma senora Juliana Munari Olá bom dia primeiramente parabenizar por todo o trabalho é uma mudança muito aguardada pelo setor regulado e com certeza gerou uma carga de trabalho de discussões muito grande pra gmesp eh queria também agradecer pela manutenção do do legado como O Fernando falou eu acho que a minha fala vai ser bem oportuna ser após a fala do Fernando que minha dúvida ligada né Eh é um meio termo interessante Tá mas eu reforço as palavras da Rosana da gente trazer um pouquinho ah de mais concretização na Norma sobre essa questão da manutenção do
legado tá a gente vai fazer contribuições nesse sentido tá na ir Isso é muito claro a gente pensou em trazer isso de uma forma um pouco mais literal pra Norma tá e a minha dúvida eu vou colocar uma dúvida também relacionada à adequação do legado a questão da Tarja verde tá então é sabido que o legado ele não tem necessidade de se adequar nesse momento a essas questões de controle de qualidade novos conceitos que estão sendo eh trazidos com essa nova resolução mas que vai ser um movimento natural como a Ana falou mesmo são extratos
de menor custo de simplificação analítica isso vai acontecendo né No momento oportuno né conforme as empresas forem estudando e adequando seus produtos por meio de pós-registro a minha dúvida é chegou o momento que um produto legado ele está totalmente adequado a essa nova legislação Mesmo tendo sido registrado à luz da RDC 26 uma normativa mais antiga tá essa Tarja Verde ela vai poder ser colocada também nesse produto legado quando ele tiver totalmente adequado ou não por ter sido registrado à luz da da RDC 26 por exemplo ele não vai poder receber essa Tarja Verde Então
essa é a minha dúvida obrigada obrigada pelo espaço e pelos esclarecimentos tá bom convido agora a representante do cff e da ufm a senora Denise [Música] coutino Bom dia a todos eh eu sou representante do Conselho Federal de farmácia mas sou também professora da Universidade Federal do Maranhão de fitoterapia de farmacogn E aí eu fiquei com uma dúvida na leitura eh dessa dessa consulta pública no que se diz respeito ao relatório de produção e controle de qualidade na subs da droga vegetal vocês excluíram na identificação o termo macroscopia e microscopia na identificação por macroscopia e
microscopia eu entendo que estará em desarmonia com a farmacopeia já já que ela traz né Eh como critérios de identificação tanto a macroscopia como microscopia das plantas e do pó também e a o perfil cromatográfico que vocês deram mais ênfase eh nas nas nos itens né no artigo 11 nos itens seguintes e eu gostaria de fazer essa pergunta e também queria saber o entendimento porque na leitura dessa consulta pública exatamente nesses nesse sub na subão sobre droga vegetal quando eu li o item 10 o inciso segundo que diz que quando o fitoterápico passar a passar
por um processo de extração Então nesse entendimento nessa leitura eu queria perguntar se vocês entendem como fitoterápico um encapsulado de um pó de uma planta como sendo medicamento porque de acordo com o formulário 2021 Ele trouxe esse entendimento né e eh eu como isso é opinião pessoal eh eu entendo esse produto como suplemento não como um medicamento e eu eu faço inclusive várias comparações em aula né e comparando uma preparação ornea um chá medicinal com essas Preparações que tem uma quantidade de planta muito menor não passam por extração a atividade farmacológica Não eu não tenho
eu nunca fiz um estudo científico sobre isso mas o entendimento é que a atividade farmacológica Ela não ela se expressa de uma maneira tão intensa Então esse eu queria fazer ess essa pergunta porque até eh antes né da nova r sobre esses registros de notificação todo o fitoterápico industrializado pelo menos que eu que eu tenho acesso são eh extratos secos ou a partir de olhos vegetais ou alguma coisa nesse sentido Então eu queria saber se essa é uma nova visão Da da da da de vocês né que estão fazendo essa regulação de de regular fitoterápicos
né como droga vegetal pulverizada que vai mudar de termo né Obrigada você que sabe quer ir primeiro ou vou primeiro Vamos lá gente é bom tá ir no evento com João porque se eu esquecer qualquer coisa eu sei que ele vai dizer se eu não puder vir ele vai apresentar tudo sozinho imagina eh só respondendo a primeira parte das considerações que foram trazidas pelo Fernando marcu sobre a questão relacionada ao alinhamento da da das normas pós-registro né em relação de fitoterápicos em relação a que vem sendo estabelecido para sintéticos está também em discussão eh eh
Fernando sim o nosso a nossa intenção é fazermos esse alinhamento obviamente obedecendo aí as especificidades as necessidades dos fitoterápicos isso não foi possível ser feito nesse momento porque hoje vendo aí tudo que foi feito em relação ao relatório deir todos esses 24 documentos aí que estão em discussão ficaria mais uma carga imensa aí de trabalho incluir essa questão do pós-registro nesse momento da revisão então eh a gente quer acompanhar para ver como vão ser os primeiros anos de eh de fato aí na prática dessa nova Norma para que aí a gente tendo como embasamento o
andamento relacionado eh a a esse a esse novo formato né relacionado à produção o controle da qualidade dos fitoterápicos a gente possa então juntar aí com eh as mudanças que vem sendo pensada e trazidas facilitações E aí modernização em relação à à Norma de pós-registro de de medicamentos sintéticos para que a gente possa então proceder com a revisão da nossa Norma da RDC 708 que trata então do pós-registro fitoterápicos então não tá em discussão exatamente nesse momento mas nós pretendemos sim eh eh promover essa discussão eh Num futuro próximo tá já considerando também Eh esses
pontos aí que foram avançados eh na Norma de eh medicamentos sintéticos Ana por favor e tá na agenda regulatória né uma proposta de de alteração das normas de pós registro que englobaria já fitoterápicos também então pode ser que saia vai sair só porque não tem gente se soubessem a situação é catastrófica gente a gente que tem que responder site paraa reunião evento analisar todas as petições que tem prazo não tem ninguém ou você faz uma coisa faz outra é é vai aos poucos e o que vai sendo priorizado começando então Fernando muito obrigada pelas perguntas
o João já falou da questão do pós-registro aí é bom que você voltou na Tarja eu queria comentar isso a tarja foi proposta porque a gente não tinha outra alternativa se vocês pensarem em qualquer outra alternativa ela pode ser alterada mas tem que ser uma caracterização que mostre pro consumidor Que fique claro que esse produto segue essas novas normas é ir pro prescritor então Eh Não importa se ele foi registrado pela Nova Norma ou se ela é um legado que se ajustou com o pós-registro se ele seguir essas novas normas ele teria essa diferenciação tá
você podem pensar como seria a gente pegou isso porque não conseguiu inventar o modo a gente puxou isso lá da consulta pública da 26 foi até um professor bem querido nosso que fez essa contribuição lá em 2013 vocês veram tanto que a gente rodou para pensar como é que podia ser essa essa essa diferenciação que a procuradoria orientou que precisa existir então todos que forem se ajustando eles vão entrar nesse momento Então quem ajustar bul e rotulagem nesse prazo Inicial Agora não tem a tarja quem vai ter a tarda é quem já produzir conforme Esse
novo método de produção um produto que é por exemplo é um extrato padronizado hoje e e já tá registrado aqui no Brasil ele não tem quase nenhuma alteração Então ele pode fazer alterações mínimas já protocolar ou pós registro ele já teria sobre esse novo modo de produção eh a questão do prazo a gente propôs um prazo baseado em outras alterações de bu e rotulagem mas a consulta pública é exatamente para isso vocês vão dizer eu precisaria de tanto tempo e por que que precisaria de tanto tempo então tudo como a gente comentou tudo que for
justificado Tecnicamente será catado Juliana eu comentei já a questão da taxa né Eh a gente não escreveu na RDC que o legado precisaria poderia ficar como legado porque a gente só precisa prever o que precisa mudar como não precisa mudar ele não precisava de previsão lembrem a renovação anteriormente era utilizada para esses momentos de adequação ela não é mais a gente não faz mais nenhuma previsão pro momento da Renovação os produtos estão renovando com aquela renovação mais simples então se não existe previsão de adequação Quem tá aí fica como está então não precisaria disso nem
no guia nem na Norma Porque eu só preciso prever a mudança se ela for feita não preciso prever ela não precisará ser feita Mas se vocês acharem que isso precisa ficar mais claro talvez a gente possa esclarecer no guia porque na Norma não precisa mesmo pode causar até mais confusão dizer Olha você que não precisa se adequar eu tô te dizendo que você não precisa se adequar É é mais ou menos nessa lógica professora Denise eu lembro da Senhora do evento da farmac você fez cada pergunta ali que eu pode deixar ela trabalha muito tempo
com fito gente eu acho que ela sabe todas as legislações decoradas que ela vai nos pontinhos assim bonitinhos então sobre a questão da identificação a norma anterior ela saía dizendo Quais eram a 26 ela sai dizendo Quais são as técnicas que precisam ser utilizadas por isso ela citava a micro e a macro na nova Norma a gente só colocou identificação não quer dizer que a micro e a macro não precisam ser feitas Elas têm que ser feitas porque eles constam da farmacopeia brasileira de acordo com a 6360 6437 5991 a farmacopeia brasileira é obrigatória então
a questão é hoje nós temos técnicas novas que algumas empresas já estão querendo utilizar como por exemplo a A análise genética o DNA Barcode e não tinha essa previsão na Norma anterior porque ela saia dizendo eu quero identificação por CCD Eu quero identificação macro e micro então a norma hoje só prevê identificação e lá no guia tem todas as formas de identificação que precisam ser feitas Seguindo os métodos que estão na farmacopeia e dizendo que podem ser utilizados esses métodos novos novos até já levando para referência aí quando for utilizar análise genética também sobre a
questão de o encapsulado de pó de planta isso já deu confusão na Anvisa por anos tanto que a RDC 48 proibia ela só permitia os extratos na 48 de 2004 foi com base no parecer da catem na época que dizia que não tinha absorção da droga vegetal encapsulada Depois de muita discussão vejam que foi mudando na 14 Ela já diz assim assim pode desde que tenha toda comprovação e depois parou de dizer que não pode porque lembra como é um medicamento eu só vou autorizar se tiver a comprovação da qualidade da segurança eficácia então só
vai ser autorizado um pó de planta que apresentou todos os testes sejam não clínicos e clínicos ou sejam os dados de tradicionalidade e precisa existir essa previsão porque tem várias plantas que funcionam melhor na forma de droga do que derivado Como por exemplo o psílio E aí a legislação tem que abranger tudo isso então sim pode desde que ele demonstre que ele tenha segurança eficácia e qualidade uhum acho que é isso né mais alguma que temos mais uma convido a representante da bfis a senhora Luzia Franco Esse povo é tudo da farmac já vem logo
ó Bom dia é não tem como não parabenizar né não colocar esse momento como importante né a gente sabe o trabalho todo né da gmesp o trabalho que a gente fez também né nessa parceria eh então é muito emocionante a gente tá aqui nessa discussão né pras empresas pro setor regulado e pro pro é um Marco importante para que a gente possa eh trazer eh o que o que faz sentido né e ter o controle de qualidade no que faz sentido para esses produtos né Eu tenho algumas perguntas né que eu acho que faz sentido
eh pelo pelas discussões pelas discussões que nós já vimos acontecer das empresas das dúvidas que surgem tá no caso doss legados para aqueles produtos que são são eh eh registrados conforme a in2 tá em quais situações eh até prevendo pós registros né vamos supor eu tenho uma alteração de uma especificação de uma matéria prima vegetal e aí o exemplo que eu trouxe que eu pensei aqui no caso de uma do da unca tomentosa que saiu da lista né de registro simplificado como a empresa Faria nesse sentido né como que como né trazer as as alterações
pós-registro nesse sentido Então essa é uma pergunta a segunda é eh os registros eh os os produtos presentes hoje com base em guaco eles têm eh uma eh São indicados para criança também a partir da da da monografia né que foi disponibilizada o limite tá ali como 18 anos Em que situações eh que o produto a ainda pode se manter ou Digamos que a gente tem uma alteração pós-registro isso pode acontecer em numa questão de de relação ao droga derivado ou alguma alteração que já está prevista hoje que nós poderíamos fazer em quais situações que
a gente teria que eh utilizar as informações que agora passaram a a estar presentes na nova nomografia Então isso acaba gerando uma dúvida pra gente realmente entender Até quando a gente vai manter esse legado e até pra gente conseguir dentro da empresa conseguir entender Quais são os desafios que a gente vai ter né em termos dessas alterações eh um terceiro ponto é que a gente a gente observa na na CP 1290 a descrição de dados técnicos científicos e literatura científica eh eles não contemplam por exemplo alguns dos em termos da descrição os livros que estão
presentes na próprio no próprio guia então é interessante a gente avaliar eh alguma outra ou literatura complementar alguma coisa para que eh fique claro que nós podemos usar algumas informações de dado de segurança de eficácia a exemplo de dissertações teses de doutorado para que fundamente essa tradicionalidade a gente entende que isso já é possível até por causa da própria lista de livros que estão presentes no Guia É só uma questão de de de casar essas informações com o que tá presente na Norma a gente vai trazer isso como contribuição mas achamos importante já trazer aqui
para vocês também um outro ponto é a questão de trazer um registro específico para inclusões de formas farmacêuticas nós entendemos que em caso de registros sintéticos Isso já é eh realizado só que para fitoterápicos eh a gente tem toda a justificativa de segurança eficácia eh basicamente igual quando a gente fala de diferenças né diferentes formas farmacêuticas então era interessante a gente avaliar a possibilidade de flexibilizar no caso de fito considerando essa particularidade que nós temos tá é isso convido agora a representante da vita Farma senora Juliana Amim Ana Cecília essa é a última inscrição para
manifestação [Música] oral Bom dia a todos acredito que estamos todos muito felizes né com essa revisão e todos muito gratos a Anvisa mas embora eu acho que a maioria de todos aqui está acompanhando essa discussão há algum tempo eh será uma novidade grande né para algumas empresas Talvez para aquelas que ainda não trabalham unicamente com fitoterápicos eh e conversando com alguns parceiros né a gente percebe que e até foi um risco eh que tá na na ir né Desse entendimento da nova classificação eh eu percebo que algumas empresas terão esse desafio né dessa classificação embora
como a a Ana falou A grande maioria são classificados como tipo outos mas eh lendo os documentos né Para Além das discussões que a gente tem com os especialistas eu queria saber da expectativa da Anvisa né da agência em relação à demonstração eh da classificação do tipo de estrato né quando ele não for não titivo descrito por exemplo uma copé Europeia o que que a Anvisa tem de expectativa para justificativa de classificação de estratos como do tipo ou como do tipo padronizado né adicionalmente Por caso de extratos padronizados em que nós temos constituintes ativos a
agência entende que estudos clínicos e não clínicos com constituinte ativo poderiam levar uma simplificação de alguma forma do registro dos estrados padronizados então mais até para aproveitar eh o momento né e trazer esses esse aliamento das expectativas mesmo do que Anvisa do entendimento da Anvisa em relação a essas questões obrigado é deixa a gente perguntar eu já ia dizer pro João perguntar se ele tinha entendido como seria só essa última parte de simplificação pros estratos padronizados então por exemplo se eu tenho estudos não clínicos e clínicos né que até essa segurança eficácia de um constituinte
ativo se eu for fazer um registro de um estrato padronizado Eu poderia usar esses estudos para simplificar alguma etapa né deixar de fazer algum estudo foi uma dúvida que um parceiro teve e que a gente algum estudo tr provic exatamente do extrato exatamente se for a substância ativa se você já isso então eu tenho para substância o constituin ativo eu tenho eu tenho até talvez no mercado esse constituo ativo registrado já tenho todos os estudos e eu vou então propor um registro de um estado padronizado nesse constituinte ativo então a esses estudos poderiam servir para
eu talvez não realizar alguns dos estudos que estaram previstos uhum obrigada muito obrigada professora Beta eu volto aqui pera aí minhas anotações tem mais um pronto então só voltando uma coisa que eu tinha esquecido professora Denise a diferença de fita e suplemento né que você tinha comentado também a definição suplemento ela é muito fechada Para resolução específica de suplemento e é relacionada com a intenção de uso o medicamento ele tem que estar relacionado à profilaxia Prevenção ou cura de doenças é diferente do suplemento que é utilizado para um fim mais específico ele pode suplementar a
alimentação e a partir de uma Vista fechada que é in 28 você lembram a in 28 que é de suplementos Então você consegue diferenciar melhor na legislação brasileira por isso que são categorias diferentes e intenção de uso diferente não é pelo produto em si é pela proposta do seu uso tá então voltando agora pro lado de cá a primeiro foi a Luzia né Luzia o legado pós-registro foi para deixar mais simples a questão no pó registro se eu entendi bem Lu acho que o último ponto que você trouxe foi o ponto referente à questão da
diferentes registos para formas farmacêuticas diferentes é isso na tá tranquilo ó Então você já tá antecipando que essa aí é são questões do segundo bloco as questões do registro simplificado vão ser já já tá eh Só passando por cima um pouco eh a nossa proposta Inicial quando foi mudar o registre simplificado já faz tempo que a gente sabe que isso é necessário porque o registre simplificado brasileiro como tá lá no na justificativa da abertura da da da das normas ele não é adequado ele não diz qual ativo deve ser utilizado então a gente sabia de
todo esse Impacto por conta disso a nossa proposta Inicial é que todos os produtos que foram autorizados antes da mudança eles não precisarão ser adequados tá essa é a proposta inicial até porque a gente não tem os textos finais ainda das monografias e relatórios de avaliação Então até esse momento permanece essa ideia a gente vai esperar terminar as consultas públicas do guaco da hca de todas mais para ver bater o martelo final se precisaria realmente adequação de algum ponto específico mas a ideia até agora que não a gente permanece com foi autorizado assim ele vai
ficar assim e todos os novos que entrarem conforme essas novas monografias e relatórios é que seguiriam todas essas orientações mais específicas mas a gente vai discutir melhor isso no próximo bloco eh a honca a gente sofreu bastante para tirar honca mas não foram encontrados os dados tanto que a gente já conversa com o Ministério da Saúde também com o Ministério do meio ambiente para fazer refazer toda essa monografia vendo se mudaram os dados eh e já tem o Edital já foram aprovados por meio do de parceria com o Ministério do meio ambiente para ver se
a gente conseguiria a gente tá discutindo muito todos esses assuntos a acabou de ter uma reunião com a USP com a farmacopéia Americana para tratar das duas uncas saber se e o guac também para saber se seria monografia distinta ou indistinta a gente tá fazendo todo o possível da nossa parte para tentar ir fechando essas lacunas e é uma coisa que assim que vou falar agora que a gente vai falar depois não é culpa da legislação a culpa é que não existe o dado não tem dado para as plantas brasileiras infelizmente e não tem como
por meio da legislação eu dizer não precisa disso porque a lei diz que precisa tudo isso eh então a gente tá tentando buscar de todas as formas possíveis para fechar esses buracos que foram encontrados quando a gente resolveu revisitar essas plantas o guaco a Espinheira a unária que realmente faltam muitos dados para todas elas é essa questão de agora a gente sabe o que falta Pelo menos vamos tentar fechar essas lacunas Tá mas a gente vai voltar a isso depois eh da forma farmaceutica aqui ó tá aberto para isso tá e a questão da forma
farmacêutica era para incluir uma nova forma farmacêutica inclusão no fu novo registro é um novo registro Só que no caso eh fazando um paralelo d de segurança deic pão basicamente meso então Eh se não teria como a gente deixar isso uma forma diferente dos demais considerando essa particularidade vocês podem pensar isso quando for republicada a norma de pós-registro tá agora nessa não tem como porque isso aí faz parte do escopo da Norma de pós-registro certinho a qual artigo contribui pode contribuir direitinho que a gente vai avaliar eu também fiquei com um pouco de dificuldade de
compreender luia considerando a argumentação que você você trouxe sobre a questão da segurança e eficácia porque assim basicamente o que a gente tem hoje de registre sintético também que vai ter relatório de segurança e eficácia é medicamento novo né ou inovador Ah o restante não tem exatamente essa informação então Eh e muitas ass algumas situações também algumas formas de forma elas são dispensadas até do estudo de bio então então essas informações também não não não vão constar ali desse dossiê no no caso do sintético quando a gente tá falando agora do fitoterápico acho que uma
documentação que vem aí forte a importância de de ressalt la e que aí eh muda completamente a documentação quando eu tenho mais de uma forma farmacêutica é a questão do relatório de desenvolvimento do produto Então acho que a gente tá bastante focado nele também em relação a isso mas por favor pode trazer as considerações aí em relação ao seu ponto de vista pra gente debater Com certeza Claro é só fazendo um um comentário sobre essa questão dos processos administrativamente é muito melhor a gente ter formas farmacêuticas em processos separados Isso facilita o pós-registro facilita eh
encontrar informação dentro do processo então pra gente e mesmo para quem consulta ter essas eh as formas farmacêuticas em processos separados é muito melhor e o que for eh de informação que possa ser repetida ela pode ser repetida mesmo né você você tem informação num processo de solução oral e você pode repetir aquela informação se for o caso num processo de de uma forma sólida não não não não tem problema com relação a isso o importante é que que tenha toda a documentação Em ambos os processos tudo ok tudo certinho Luzi a gente vai continuar
gente é é um momento de discussão aqui é só mais para tirar dúvida Vocês precisam todas essas ideias manda no processo que vocês vão contribuir a gente vai considerar eh a Juliana da vita Farma como classificar os extratos a gente já as associações Já perguntaram isso pra gente a gente foi buscar na legislação europeia porque seguindo o modelo europeu e não existe esse escrito até onde a gente saiba em nenhuma nenhum texto da legislação europeia então a gente pegou respostas das pessoas de lá a gente tem muito contato com a agência portuguesa agência alemã depois
de anos na OMS a gente recebe eles aqui vai para lá visita são grandes amigos e eles elaboraram as justificativas mais básicas com base com que tá na farmacopa europ e com base nas respostas que eles nos deram tá escrito o segundo parágrafo da página 101 do guia que é dizendo que basicamente é com base em estudos clínicos então tenho que ter o estudo Clínico da substância com atividade terapêutica e a e o extrato todo para mostrar que é igual Além disso são aceitas exceções em dados quando tem muito dado na literatura E aí eu
teria que ter vários dados de estudos não clínicos demonstrando que realmente aquela substância teria o mesmo efeito do extrato como um todo então a gente escreveu que a gente consegui extrair deles porque não tem isso Nenhum documento da legislação europeia como é que a gente entende isso na prática hoje vai ficar como padronizados que estão já definidos na literatura como padronizado todos os outros os quantificados também ficam os que já estão definidos principalmente na farmacopa europeia e todos os os outros neste momento seriam outros pelo menos das plantas brasileiras do que a gente já viu
até agora então é isso se eu tenho que ter ou um estudo Clínico comparando um braço com a substância selecionada e o extrato como todo ou muitos dados de literatura que me permitam dizer que realmente essa substância tem o mesmo efeito do extrato como um todo é a resposta que a gente tem da legislação europeia que é o que a gente vai seguir tá como era acho que o segundo ponto que a Juliana trouxe foi em relação a a possibilidade de utilizar né esses dados como parte da comprovação de segurança eficácia para exentar aprovação de
alguma de algum outro dado eh isso vai depender muito do dado e do do produto que se pretende eh registrar a partir dele então é uma avaliação que é feita caso a caso a gente tem como generalizar aqui mas eh uma abordagem que já é aceita por nós já é recomendada pela OMS é o que tá publicado no guia eh de ensaios clínicos né para fitoterápicos naquela versão que foi traduzida aí pelo Ministério da Saúde que a gente usa e emprega hoje então a gente eh tenta aproveitar o máximo as informações que já estão disponíveis
mas aí em uma avaliação individual de cada caso Basic ente a comprovação É para um insumo ativo específico então a comprovação mesmo em extratos padronizados é pro extrato padronizado Então essas informações elas podem ser entendidas como adicionais mas eu não posso só com base em o a segurança eficácia de uma substância isolada registrar todo um fitoterápico a gente tem que lembrar que uma das mudanças principais aqui é descolar a qualidade da segurança eficácia antes a legislação brasileira era assim é o marcador tudo é isso aqui que vai dar segurança eficácia agora essa questão do estrato
padronizado quantificado e outros é por controle de qualidade a segurança eficácia permanece do ifav não tem relação com essa diferenciação entre as três categorias as categorias de extrato são pro controle não para segurança efic obrigado Ana eh tivemos três manifestações também que recebemos aqui por meio do QR Code eu gostaria de verificar com vocês que enviaram as manifestações Se não gostariam de vir até aqui à frente primeiro é o Dr Rafael polone por favor se puder vir tá à frente Bom dia Bom dia eh enquanto Ministério da Saúde a gente parabeniza Ana João toda a
equipe eh por esse trabalho porque todos sabem que a gente tem uma dificuldade de incorporar novos eh Fito na Renam Esse é um trabalho incessante nosso enquanto Ministério enquanto coordenação da da política eh Nacional de plantas medicinais fitoterápicos então eh a gente vê com bons olhos toda essa padronização com parâmetros internacionais para que a gente tenha mais e mais respaldo para que junto a conitec a gente consiga incorporar novos fitoterápicos na Renam Esse é um trabalho que a gente não vai parar enquanto conseguir atingir eh eh o patamar que a gente quer né porque desde
2012 não há incorporação de novos fitoterápicos eh na relação Nacional eh então parabenizo a equipe eh de ter todos esses eh eh esse alinhamento internacional que vai nos subsidiar para galgar novos fitoterápicos eh na rename e além disso eh de 2023 para 2024 a gente eh enquanto o Ministério da Saúde conseguiu aumentar em cinco vezes o orçamento Federal para plantas medicinais fitoterápicas então a gente já fez o primeiro repasse ainda em 2024 com aporte de mais de R 30 milhões deais para os municípios para eles comprarem plantas medicinais fitoterápicos ações de qualificação e todos todas
as outras ações é um recurso que nunca existiu então a gente e eh Vê com muito muito otimismo o resultado disso e obviamente vai permitir que todos os municípios consigam comprar e medicamentos fitoterápicos e da Renam então é nosso objetivo e é levar paraa conitec essa pauta novamente e tá em revisão todo marco regulatório de incorporação de tecnologias no SUS então a gente já levou essa problemática para o secretário pro Ministério como um todo para que a gente consiga ter uma abordagem diferenciada para as plantas medicinais e fitoterápicos é só uma contribuição mesmo e parabenizar
mais uma vez o trabalho de vocês Muito obrigado Rafael o próximo é Alisson mora e Silva se puder vir até o púpito Bom dia eh gostaria de parabenizar a todos pela discussão acho enriquecedora para nós do setor regulado e eu sou do analítico então a minha pergunta foi bem direcionada pra parte analítica especificadamente o item P 2.3 do guia que trata de testes de extraíveis eh esse item está dentro ali do contexto de controle de qualidade de produto acabado fazendo menção à necessidade da quantificação de extraíveis Em algumas situações específicas de material de embalagem em
produtos acabados eh a minha dúvida e sugestão seria a qual seria questionar a vocês qual seria a expectativa da agência ao mencionar esse teste dist extraíveis uma vez que para produtos acabados geralmente conceitualmente a necessidade de quantificação são de lixiviáveis né que e em conceitualmente são diferentes de extraíveis então ah lá no no item cita algumas exceções né onde o teste não é realizado não é solicitado mas no fato de quando ele é solicitado Qual a expectativa de vocês em quantificar ess í veis e porque não lixiviáveis né e outra questão é do desafio analítico
dessa quantificação mesmo que seja para lixiviáveis uma vez que em um produto fitoterápico onde se tem milhares de substâncias químicas fazendo parte da composição é extremamente difícil você isolar Qualquer que seja um dos compostos e em quantidades mínimas que se esperam né então no caso de ah medicamentos sintéticos existe tem algumas abordagens de simulação eh de de PH log de p e etc para determinar Esse estudo de lix viáveis para fito Qual a expectativa da agência obrigado obrigado Alisson eh próxima manifestação David Silva por favor é desligaram bom dia a todos eh assim como todos
gostaria de agradecer tá pelo evento a oportunidade eu acho que é importante pros principalmente pro setor lado a gente tá discutindo essas consultas porque vai ter bastante Impacto né nas indústrias nas empresas e é importante essa discussão antes mesmo da da Norma estar vigente eh eu cheguei um pouquinho atrasado Ana e até peço desculpas porque na hora que eu cheguei você estava falando algo sobre nitrosaminas e eu fiquei com uma dúvida O que que a gemes espera se tratando de nitrosamina eh o que se espera ser apresentado para a gesp no controle de nitrosaminas porque
atualmente hoje para os sintéticos nós já temos né traçado ali no qual a gente apresenta um relatório com uma avaliação de risco no qual é feito um controle ali por intermédio dos recipientes e do inclusive do próprio IFA e pensando no fato do fitoterápico seria também um relatório com uma avaliação de risco similar e o que seria cobrado principalmente dos Fabricantes do do insumo Vegetal muito obrigada Rafael obrigada pelas suas colocações é a Anvisa trabalhou junto a Ministério em toda essa política de fita então a gente tentou fazer tudo em conjunto trabalhar em conjunto é
o prazer ter vocês aqui tá eh inicialmente do Alisson sobre os list viáveis que vai acabar sendo a mesma resposta pro Davi sobre as nitrosaminas eh a proposta desse guia é implementar Os guias da legislação europeia aqui no Brasil então eles são Se você pegar o guias você pegar a legislação europeia eles são exatamente traduções da legislação europeia e lá existiam esses itens né a nitrosa minas foi por meio de uma denúncia de um produto específico que a gente começou a discutir os Lis viáveis foi na época que tava sendo feita a toda a discussão
da Anvisa el chamaram a gms vocês vão participar ou não e a gente começou a discutir E aí foi falar com a legislação com o pessoal com esses amigos que a gente teria lá na legislação europeia também e aí está no guia o texto exatamente traduzido da legislação europeia do guia geral que eles T que tratam do assunto e a especificação que tem depois que é dizendo assim olha você precisa primeiro Listo de viáveis extraíveis você precisa fazer todas as análises se não utilizar um vidro ou um recipiente que não estejam descritos ou em farmacopéia
oficial ou que já seja utilizada em um alimento registrado então A ideia é isso seria necessário se a empresa inventar um vidro novo um componente de embalagem totalmente novo porque ele é automaticamente dispensado para quem usa todos esses materiais de embalagens que já estão descritos e utilizados exatamente por conta dessa dessa dificuldade de fazer com fitoterápicos a gente até perguntou para pro pessoal da legislação europeia porque ele só tem aquela o texto que tá lá sobre extraíveis e Lis viáveis é o 90 do do do guia página 90 então ele começa a traduzir o guia
M ela tem uma complementação que a gente colocou da resposta que eles deram pra gente tanto que no guia não tem isso que não precisa fazer com com os materiais que já são utilizados em outros produtos porque quando a gente perguntou eles disseram que tinha que fazer sem lá a gente mas como que vai fazer isso em fitoterápica eles não mas calma só faz quando a empresa resolve utilizar um material de embalagem totalmente diferente então todos os que são descritos então A análise tá totalmente prevista então é um teste novo como vai ser exatamente a
gente ainda vai começar a estudar mas na prática ele disseram que não faz para quase nenhum doss produtos que tem lá do de de LX viáveis olha não há essa previsão nesse momento de nitrosaminas não existe essa previsão nesse momento é porque eu ainda tô nos listes viáveis eu vou já para nitrosamina só um minutinho tá então resumindo tradução do Ema o guia todo é tradução do Ema com algumas etapas algumas partes da legislação europeia ou da ou ou canadense ou da OMS vocês podem ver e visitar esses documentos então a gente fez e quando
perguntou para eles ó e aí como é que vai fazer esses exra de list viá Vocês conseguem esses dados Eles responderam não na prática não porque o que ocorre é isso só vai ser pedido quando for um material de embalagem totalmente novo então essa resposta que a gente tem doema até agora como a gente vai avaliar na prática nós vamos ter que quando chegar o caso concreto nós vamos ter ter que estudar igual a gente parou estudou agrotóxico estudou micotoxina Talvez daqui um tempo quando chegar o primeiro caso se a empresa resolver utilizar uma embalagem
totalmente nova a gente vai ter que publicar uma nota técnica olha no caso concreto faça isso isso e isso para nitrosamina porque até para extraíveis e lixiviáveis porque ter que até agora a gente não teve dá eh Rogério se você quiser completar nitrosamina fica à vontade também tá nitrosamina se vocês virem como eu comentei na apresentação também é tradução do guia em é um guia recente é uma uma orientação geral e que ela é obrigatória para todo o fitoterápico novo a ser registrado Então esse é o primeiro ponto eu não preciso fazer para quem já
tá autorizado mas um produto novo vai fazer uma análise de risco eu vou ver com base na composição do meu ifav Quais são as moléculas principais que tem ali desse produto em relação aos recipientes que são utilizados materiis de embalagem se existe a possibilidade de formação de nitrosamina essa análise de risco com base em dados de literatura inicial que será feita se verificar que sim Há a possibilidade de formal a nitrosamina a partir da composição de alguma substância específica conhecida dentro do seu extrato vegetal é que você vai fazer toda a análise então de novo
é uma tradução literal do que tá lá no Ema nós não tivemos só esse caso prático até agora né que o Rogério quem acompanhou mais de perto e na medida que isso for sendo implementado Possivelmente quando a gente começar a estudar vai ter publicado uma nota técnica específica também é só complementando na prática o que a gente vem recebendo são exatamente isso avaliações de risco avaliando a probabilidade de Formação considerando não só o insuma tio mas também o acondicionamento e todos os recipientes incluindo a água que nesse caso que foi relatado foi justamente aí que
teve né através dos nitritos presentes na água a gente teve essa formação de nitrosaminas mas é exatamente isso que a gente espera eu acredito que tem algumas literaturas que para alguns recipientes ou Para alguns insumos isso esteja mais claro que essa formação ela é mais presente então pode ser buscado na literatura científica também muito novo até poema eles estão aprendendo agora mas como a gente tá fazendo a revisão a gente já tinha que incluir aqui como orientação inicial Tá a gente vai aprender em conjunto e Davi não tem previsão de revisão da 677 só para
incluir isso porque como eu comentei não sei se você viu ela é uma Norma traduzida literalmente do i e o ch não regula fitoterápico Então essas normas que forem traduzidas diros C elas não vão se aplicar diretamente por isso que a gente sempre teve um guia dizendo olha para fito na estabilidade é isso eh produto de degradação é isso tal coisa faça assim porque realmente a gente não faz parte normalmente de todas essas normas são traduzidas do ich aí vão ficar nas nossas normas e aí o que a gente pode fazer e aí a gente
conta também com a contribuição de vocês durante a consulta pública do guia Quando ele entrar em consulta pública é melhorar mesmo o texto de orientação em relação ponto específico viu Davi então quando a RDC for publicada o guia entra em vigência mas em consulta pública e aí a gente tem oportunidade fazer melhorias nele a gente teve mais eh duas inscrições mas essas duas inscrições elas tratam da das instruções normativas então elas vão ser tratadas no segundo bloco aí eu peço Só que quem fez fez essas inscrições que aguarde um pouquinho que a gente vai ter
um intervalo agora de 10 minutos a gente retoma com a apresentação do segundo bloco e na sequência com as dúvidas também referentes a esse segundo bloco Tá certo então a gente tá parando agora às 10:57 Voltamos às 11:07 por favor segundo bloco eh Onde serão apresentadas então né a AC CP referente a as instruções normativas as três instruções normativas ah são as CPS 1291 1292 1293 vamos falar também um pouco sobre o edital de chamamento público número 13 também então Ana quando estiver pronta por favor ó Bom dia todo mundo de volta vamos voltando Obrigada
pela atenção até agora e a gente vai falar um pouquinho sobre aenes que foram publicadas que serão publicadas em conjunto A partir das consultas públicas 1291 92 e 93 Então a primeira é a 1291 que ela traz a lista de restrições ela é uma junção do anexo um e do anexo 2 da RDC 26 então foi atualizado algumas especificações para substâncias que são consideradas tóxicas do anexo um e foi mantida a lista de plantas que são proibidas né do registro como produto tradicional fitoterápico resumidamente é isso então o anexo 1 da RDC 26 era a
lista de espécies que não podem ser utilizadas na comprovação da segurança eficácia por tradicionalidade porque são plantas que foram selecionadas com base em listas de restrições de outros países ou no livro de plantas tóxicas brasileiras E sendo tóxic que ela não pode Teoricamente ou tendo substâncias que T algum risco ela não pode ser registrada como produto tradicional então eh a manutenção não foi adicionada não foi retirada nenhuma planta a única coisa que foi corrigida foi que foi dita a espécie específica para cannabis sativa que antes ela era cannabis SP hoje o conhecimento Botânico atual é
que seria cannabis ativo em relação à lista de espécies vegetais com restrição de registro e notificação como eu comentei houve só uma atualização eles deixam de ser anexos da Norma principal para serem publicados na forma de in ter uma republicação mais simplificada quando precisar atualizar a lista lista Às vezes a espéci ou alguma substância específica que precisa ser controlada como os alcaloides pirrolizidínicos então eles já estão estão aí desde RDC 26 e seguindo muitas vezes nesse caso aí as monografias da Comunidade Europeia então eles todos agora vão fazer parte dessa instrução normativa em conjunto de
restrições e esse é o texo né ele traz restrições tanto pro medicamento fitoterápico como para ptf de substâncias que não podem ser utilizadas nessas categorias e o anexo um seria das plantas que não podem ser utilizadas como TF lembrando quase não tem alteração elas só estão sendo trazidas para ins específicas em vez de serem anexos da Norma E aí também a orientação que devem ser utilizadas sinonímias quando eu tenho só uma espécie descrita lá esse é o texto completo A gente só fez trazer aqui as restrições elencadas no anexo do devem ser seguidas tanto para
ptf quanto MF devendo ser verificadas sinonímias botânicas e solicitantes devem proceder com revisão de dados técnicos científicos verificando que contoles se aplicam a cada matériaprima vegetal de modo a garantir a segurança do fitoterápico porque isso tem que ficar muito claro responsável pela qualidade segurança eficácia é o detentor do registro ele tem que fazer essa revisão a cada novo produto que for solicitado o registro e por isso que é dito que essas refletem a informação obtida nesse momento ela precisa sempre ser atualizada quando num pedido de registro Então esse é é a lista agora de de
restrições ela foi atualizada em relação a algumas orientações quanto a espécies de menta e também Artemis e salve oficinalis mas todas as outras restrições já estavam desde a RDC 26 e a do Boldo era uma nota técnica que tava disponível no site a gente incluiu aqui só para ficar mais claro também o anexo 3 da rc26 era a lista de referências para comprovação da tradicionalidade de uso de fitoterápicos e a norma ela era omissa em dizer que poderiam ser utilizados outros livros então a norma agora tá bem clara dizendo que esses podem ser utilizados Mas
podem ser utilizados outros e é a lista deixa de sair da RDC principal e ela passa para ser uma lista orientativa no guia então podem ser utilizados esses Livros mas também podem ser utilizar os outros esses aqui já foram previamente validados pela Anvisa a gente já conhece já entende que são livros bons em relação à comprovação da segurança eficácia então se você vai mandar um livro outro que não está nessa lista você vai fazer essa revisão e vai apresentar eu tô apresentando esse livro porque ele tem essas informações a mais que não tem na lista
padronizada pela Anvisa se vocês quiserem incluir também novos livros é o momento agora né Vocês podem sugerir que a gente vai incluir se possível enviando uma cópia da literatura para que possa ser avaliada que a gente não vai ter tempo de comprar compras públicas tem que passar por todo o processo de licitação então quiser incluir por favor acompanhe fazendo a doação paraa biblioteca da gmesp eh a a lista de livros é quase a mesma da EDC 26 do anexo 3 foi incluído apenas um livro que foi lançado pela Fiocruz especialmente aí em homenagem ao professor
Gilbert que faleceu há pouco tempo que também é um grande batalhador nessa área então a gente já avaliou esse livro ele já saiu também é a única atualização nessa lista de livros até agora podem sugerir a inclusão de quantas mais quiserem aí daí a gente vai pra consulta pública 1292 a consulta pública era o anexo 5 da RDC 26 então ela traz exatamente a mesma lista como é que essa lista foi publicada quando começar se a discutir A análise de agrotóxicos as farmacopeas dizem avalia essa lista mais a listas de resíduos que é comum no
país de origem e a gente não tinha essa lista de resíduos pro Brasil então Foi questionado a a GG tox a gerência de tecnologia e eles passaram essa lista que segundo para o programa de monitoramento de resíduos de agrotóxicos em alimentos seriam os resíduos mais encontrados nas culturas cultivadas aqui no Brasil então essa é a mesma lista que tá lá no anexo 5 a gente cons colocou em consulta pública para ver se precisaria ter sugestões de atualização de algum item mas não mudou nada em relação ao que tinha antes como eu tinha comentado com a
pergunta da Rosana a lista é só dizendo avalia esses as regras de avaliar estão na Norma geral a partir do método disponível na farmacopeia brasileira e agora vamos para registe simplificado que é a consulta pública públ 1293 de 2024 então desde que foi publicada a RDC 26 é que já sabia que precisaria mudar o quadrinho no registro simplificado porque ele é muito simplificado em relação à comprovação da segurança eficácia então desde aquele tempo foi feito um projeto de contratação de pesquisadores para fazer a atualização dessa lista lá no passado quando a gente tinha 42 pessoas
a gente conseguia fazer bula padrão a gente conseguia fazer todos esses documentos agora não tem mais Então essas coisas são feitas por meio de de contratações então a contratação foi feita via CNPQ foram contratados especialistas que fizeram revisão dos dados do registro simplificado depois que eles devolveram esses dados pra gente dizendo Olha só existe esses dados aqui disponíveis para essas plantas a gente faltou arrancar o cabelo se desesperou tá faltando um monte de dado para as plantas brasileiras e conversando dissse vamos chamar o setor produtivo Pode ser que eles tenham mais dados do que o
setor do que os pesquisadores que foram contr dados para fazer essa revisão então a gente chamou de novo todas as 10 associações e disse olha a gente contratou alguém e eles só conseguiram esses dados aqui vocês podem buscar se tem mais dados até porque essas pessoas contratadas não tinham todos os livros que tava lá no anexo 3 da RDC 26 então o setor fez essa revisão incluiu novos dados mesmo depois dessa revisão não foi lert mesmo depois da revisão de todos esses dados foi feito lá Nadal eh a partir de um contrato de todas as
associações a gente viu que ainda estavam faltando mais dados buscou em nossos livros tentou adicionar pediu dados de farmácias vivas tudo que a gente pode fazer para publicar esses relatórios de avaliação e monografia O mais completo possível a gente correu atrás Então o que está em consulta pública hoje é o que a gente conseguiu nós os pesquisadores e a associação as associações do setor produtivo isso é de acordo com o que é previsto na legislação que está disponível na literatura para essas espécies que foram avaliadas aí é que agora na consulta pública a gente veja
se não tem mais dados que não conseguiram ser encontrados para que as monografias e relatórios de avaliação sejam publicados da melhor forma possível a as consultas pú os trabalhos estavam sendo feito concomitantemente a alteração do registro com a alteração do registro simplificado e acabou que por fim a gente juntou toda essa discussão na no air do do da Norma Geral de registro mesmo entendendo não sendo necessário uma análise de impacto regulatório específica como vocês podem ver lá na na página e por fim estão disponíveis para consulta pública 17 textos técnicos englobando pareceres monografias e relatórios
de avaliação Então o que seria o registre simplificado acho que todo mundo já conhece mas só para lembrar é uma lista em que de plantas ou de insumos ativos específicos para os quais não são necessários dados adicionais segurança e eficácia porque essa segurança eficácia foi previamente padronizada pela agência reguladora então a lista foi criada junto da RDC 17 que foi a primeira Norma da Anvisa e tinha 13 espécies nesse mesmo formato feito hoje em dia que é um quadro que a gente vai ver aqui ela foi evoluindo com o tempo com as resoluções mas o
formato continua igual foram adicionadas novas espécies mas esse é ainda hoje o formato do registro simplificado brasileiro e como eu comentei ele é muito centrado centrado na dose diária dos marcadores então não diz qual é ins sumativo específico que deve ser utilizado não traz mais detalhes de contraindicações restrições de uso interações e por isso ele é considerado deficiente vocês podem ver toda essa discussão lá na página da consulta pública também como não tem um insum ativo específico que deve ser registrado na na lista de registro simplificado brasileira foi preciso prever na in4 que é o
guia que Enquanto essa informação não tivesse disponível era responsável do detentor do registro do cara que fosse Pedir o registro buscar essas informações para definir qual seria o o extrato e o o o o o método de obtenção específico para o ins sumativo que tivesse a comprovação a gente não fazia essa revisão porque saiu como uma uma eh uma ação a ser feita pelo detentor do registro mas depois que a gente começou a fazer as revisões a gente viu que muita gente não tava fazendo então a gente começou a pedir tem frase padrão hoje se
não chegar toda essa justicativa a gente pergunta olha me manda comprovação que esse é o ifv correto para essa espécie vegetal por conta disso não adianta dizer que guaco com tantos miligramas de tal coisa é seguro eficaz eu preciso dado do guaco específico do insumo específico obtido a partir de guaco e t guac houve muitas discussões isso aí vem desde 2014 também e a proposta por fim depois de muitos estudos e discussão é padronizar já que a gente tá padronizando o controle de qualidade da legislação europeia utilizar também os modelos de monografia e relatório de
de avaliação publicados pela legislação pé até porque lá eles se conectam a monografia da farmacopéia é ligada com a monografia de segurança eficácia então a ideia era que aqui também fosse E também porque essas monografias do Ema já são padronizadas no Brasil desde a RDC 26 então não tinha porque utilizar um modelo diferente por mais que a gente já tivesse estudados muitos modelos então entendeu-se que o modelo do Ema seria mais apropriado porque ele é bem centrado nas informações regulatórias necessárias para comprovar a qualidade a segurança eficácia de um produto Então as monografias estão aqui
vocês podem visitar no site do Ema E eles vêm acompanhado com o relatório de avaliação que traz todas as informações disponíveis na literatura sobre aquela espécie vegetal na data da sua publicação então a monografia específica pro ifav que você vai registrar ela só diz olha tem comprovação para esses ifvs aqui mas o relatório de avaliação é uma revisão de toda a literatura sobre aquela espécie então esses pesquisadores foram contratados O contrato foi esse aqui chamado CNPQ número 17 em 2017 para revisar os dados técnico-científicos de atualização e inclusão de novas espécies vegetais no registro simplificado
de fito o objetivo era atualizar não ficar mais com quadrinho ter uma monografia completa com todos os dados sobre cada uma dessas espécies e ter concomitantemente o relatório de avaliação porque era uma coisa que as pessoas perguntavam demais é de onde veem essa informação que tá aí na in2 e a gente não não tinha todo D literatura a partir de agora o relatório de avaliação vem dizendo olha essa informação aqui veio da referência tal essa informação veio da referência tal então tá tudo Claro para essas espécies que foram avaliadas a gente tem esses dados e
a gente sabe o que é que tá faltando tá tudo descrito lá quando vocês forem ler cada um desses documentos então de todos os modelos como eu comentei depois de muito estudo is é uma das coisas que a gente mais estuda é qual seria o melhor modelo o ministério usa um modelo que a gente trabalhou mas ele é mais amplo ele tem também dados de controle de qualidade tem dados de patentes que não tem aqui que que é especificamente voltado para segurança eficácia Então por fim decidiu-se utilizar esse modelo do hmpc e a ideia é
tudo que tem publicado na legislação europeia a gente que já tem isso padronizado na rc26 assume eh como a espé a monografia para aquela planta e o que não tinha que já tava na in2 a gente teve que complementar para publicar complementando o que tinha dados no modelo da legislação europeia esse modelo é muito utilizado em vá vários países se você compara com os da OMS do Health Canada ele é realmente o mais adequado pra comprovação da segurança eficácia por registo simplificado e e isso precisa ser feito porque a lei 6360 Ela é bem clara
ela diz que o registro de medicamentos depende que o produto seja reconhecido como seguro eficaz pro uso que se propõe e possui identidade atividade qualidade pureza e inocuidade necessárias e que não se pode né registrar um medicamento que não tem sua composição substância reconhecidamente Ben é do ponto de vista Clínico terapêutico a Helen que é do ministério tava até conversando no intervalo quando vai pra conitec quando a gente sofre porque o médico o pessoal da conitec médico acostumado com aquele modelo padrão ouro de estudos e tudo mais que a gente não tem para fito é
diferente não ter todos esses dados mas a legislação brasileira diz que tem tem que ter todos esses dados então a gente fica aqui patinando entre o que a lei diz para garantir toda a segurança eficácia O que é que tem nos dados das plantas brasileiras e o que é que a gente consegue disponibilizar Para comprovar essa segurança eficácia de forma mais simples a gente espero que daqui a 30 anos tenha todos esses dados quem sabe pelo menos agora que a gente já sabe o que não tem talvez a gente conseguir preencher nessas lacunas então lá
na página da consulta pública 1293 vai ter vários documentos vocês podem entrar lá tem toda a questão da situação motivadora da abertura porque que isso tá sendo feito é uma obrigação legal e mais do que uma obrigação legal é uma questão técnica o registro simplificado no modelo da in2 ele não é registo simplificado ele não traz todos os dados necessários para comprovar segurança eficácia e aí tem lá o formulário de abertura onde vocês podem ver toda essa discussão de de análise de impacto regulatório e aqui eu parecer que com as justicativa eh regulatórios e dispensa
de air então tem muitos documentos que estão lá produzidos que a gente pede que vocês leem para poder acompanhar todas essas contribuições Esse é o texto da consulta pública 1293 e ela dispõe sobre a lista Brasileira de espécies vegetais que podem ser registradas por meio do regime simplificado como ptf por que que ficou como ptf porque a gente não achou nenhum dado de planta que ficasse como medicamento fitoterápico Então se na consulta pública chegar qualquer uma que vá ser de registro simplificado por medicamento fitoterápico a gente muda aqui para ptf e MF mas as que
estão todos só tinham dados como dados de tradicionalidade as espécies vegetais listadas no quadro um disponível no nex poderão ser registrados por meio do registre simplificado como produto tradicional fitoterápico porque não teve nenhum que teve os dados não clínicos e clínicos para cmf e devem ser seguidas como sempre no registro simplificado todas as especificações previstas na monografia publicada para cada espécie vegetal e as monografias e o relatório de avaliação estão disponíveis no portal da Anvisa eh aqui ó Ficou claro já que tinha toda essa discussão se precisava ou não adequar né que MF e ptf
autorizados pelo regist simplificada anteriormente à publicação dessa resolução não terão que se adequar ao previsto nessa in e revogam-se a in2 então basicamente Esse é o texto normativo e ele vem trazendo essas espécies vocês podem ver que a levigata até ainda Consta aqui a gente ainda tava discutindo se a levigata ficaria aqui ou não e Mas vai ter toda discussão lá no parecer no relatório de avaliação sobre essa questão que foi o que deu mais discussão essa Norma tava pronta faz tempo e a gente ficou um tempão discutindo con setou a questão do guaco eventos
específicos sobre isso porque a gente sabe do tamanho do impacto mas não tem como dizer que é de registro simplificado uma planta que não tenha todos os dados necessários conforme a legislação antes a gente não sabia que esses dados não existiam a gente imaginava que eles existiam porque veio de todo um processo histórico de construção do registro simplificado assim mas hoje a gente tem um documento dizendo que o dado não existe e não tem como fechar o dado os olhos para isso então foram essas espécies aqui dentro as avaliadas que foram consideradas como í veis
de ter relatórios e monografias a partir do modelo da Ema por terem os dados que comprovem seja aí por tradicionalidade E aí esse trabalho foi muito feito em conjunto com formulário de fitoterápicos da farmacopeia brasileira tanto que várias consultas públicas já foram refeitas lá a monografia da maiten monteverdia já foi modificada com base nessa revisão a monografia da Goiabeira já foi modificada com base nessa revisão também porque a gente tentou fazer as informações em conjunto não tem porque eu ter formulário de um jeito e o e o registro simplificado de outro jeito então foi definido
que formulações que são passíveis de notificação elas não ficam vão ficar no registro simplificado porque se eu sou passível de notificação o caminho é a notificação né é o caminho previsto e obrigatório agora bem claro na nova legislação como eu comentei foi muito em conjunto com o formulário tanto que esses dados que vieram dos professores a gente complementou com dados que foram conseguidos por formulário algumas coisas são diferentes porque lá no no formulário as decisões são colegiadas Anvisa tem um voto no meio de sete votos no registro simplificado não é o que a gente entende
que é o mais correto porque muitas vezes a gente dizia não esse dado não é tão bom aí os professores diziam não não tem 30 anos mas eu uso essa formulação há tanto tempo e aí saiam juntando informações verbais que permitiam que o colegiado aprovasse determinadas coisas que a gente não tinha aqui por escrito para aprovar no registro simplificado como eu comentei caso apareça as novas informações sobre essas espécies ou qualquer outra tanto que no edital de chamamento público tem o espaço para você incluir Olha eu quero uma nova espécie mas por favor quem for
sugerir uma nova espécie manda a monografia e o relatório de avaliação não adianta dizer incluam tal planta a gente não tem tempo se for para incluir uma nova é uma nova contratação e vai demorar muito tempo não dá para fazer vocês podem sugerir mas tem que sugerir Joca monografia o relatório de avaliação todo Pronto quem tem a monografia do Ema foi adotada e foram Depois de revisadas várias espécies que se encontrou dados para a inclusão do Capim Santo e da Goiabeira outras espécies foram estudadas além das que já estavam no registe simplificado né que tiveram
que fazer as monografias foram estudadas também o trolos ac cód e não tiveram dados suficientes para inclusão então eles não preenchem todos os requisitos a gente trouxe até o exemplo do do da da cóia da varronia Curaçá fica aqui para discutir porque é uma planta modelo que sempre se fala que que é a planta mais estudada no Brasil Mas mesmo sendo a planta mais estudada no Brasil ainda tem vários dados faltantes disponíveis na literatura esses dados provavelmente estão lá no processo do registro Mas a gente não pode utilizar esses dados porque eles não são públicos
na literatura não tá E foi sugerida a exclusão de três espécies que hoje estão na in2 a centela a unha de gato e a cava-cava e para todas essas foi feito um parecer justificando porque que essa espécie não poderia permanecer no registro simplificado a centela é porque todos os dados existentes e disponíveis na literatura são para extratos altamente refinados eles deixam de ser fitoterápicos e passam a ser fitofármacos então ele não pode estar aqui no registro simplificado de fito a unha de gato não foram encontrados dados também nem por tradicionalidade nem por meio de estudos
não clínicos e clínicos com base numa revisão prévia que foi feita pela Comunidade Europeia e como essa revisão foi feita pela Comunidade Europeia com alguns requisitos um pouco diferenciados e alguns anos atrás a gente tá pedindo agora um contrato para fazer uma nova revisão PR unária e a Cava Cava foi excluída do registro simplificado por conta de toda a discussão do da toxicidade relacionada às caval lactonas mas isso tudo tá detalhado em cada um desses documentos que estão lá paraa consulta pública então para Goiaba foi feito um relatório de avaliação e monografia para o decocto
das Folhas vejam que é pro ifv específico eu tenho que dizer qual é a parte da planta Qual é o o o a forma farmacêutica e todas as informações para aquele IFA ver pro Cap Santo foi o relatório de avaliação e monografia pro óleo essencial infuso das Folhas para Mont verde que é a maiten né o nome novo da da espinheira santa o relatório e avaliação e de avaliação e monografia por decocto infuso e o extrato das Folhas paraa mican aglomerat relatório de avaliação e monografia para decocto infuso tintura das Folhas para levigata foi feito
o relatório de avaliação e os dados que foram encontrados Eles eram muito similares ao que tá no formulário Então preferiu-se nesse momento com os dados que tem nesse momento não tem a monografia porque o que tem ficaria lá na na na notificação no formulário a poligal cênica tinha na in2 então foi preciso fazer apesar de não ter tanto Impacto não ter tantos produtos autorizados foi feito porque tinha essa proposta de adequar tudo que tinha na in2 foi feito o relatório de avaliação e monografia pro decocto infuso e tintura das Folhas a centela como eu comentei
um parecer de exclusão por não ser fito o Piper pela toxicidade que é a Cava Cava a unária não foram encontrado dados suficientes assim como pro tribos e pra varonia Curaçá a gente não tem tempo de debater todos aqui infelizmente mas estão todos lá em cada um dos documentos vocês podem ver cada uma dessas justica Ou seja a Anvisa buscou Alguém pediu para procurar o que é que tinha e tá dizendo o que é que não tem se você tiver esses dados por favor contribua a gente quer incluir o máximo de plantas mas infelizmente do
que a gente buscou até agora tá tudo justificado aí porque é que não vai incluir ou porque é que vai ser Preciso excluir Então esse é só um exemplo da cóia né que é sempre utilizada como modelo e aí quando a gente diz ah vamos fazer monografia a primeira que se pensou é cóia eh Por que que não pode ser feita a monografia porque tem vários pontos específicos da legislação de registro que não foram eh encontrados na literatura por exemplo não foram encontrados estudos de genotoxicidade pro ifav específico que tem dados de tradicionalidade estudos não
clínicos e clínicos não foram encontradas três referências de uso tradicional para o na descrito na literatura os zas que estão na literatura não estão corretamente caracterizados isso é um grande problema o Newton participou por anos desse comitê eh você tem 50.000 publicações da do Capim Santo que é a planta brasileira mais estudada dessas 50.000 você não consegue extrair quase nada porque as informações são para insumos específicos diferentes ou quando é pro mesmo insumo ele não tá bem descrito você não consegue obter muitas vezes essas informações não for foram encontrados dados suficientes para autorização como medicamento
fitoterápico porque faltavam os dados de genotoxicidade e também outros dados não clínicos os dados clínicos estão disponíveis na literatura mas os não clínicos faltam vários E aí foram elaborados além do relatório monografia pra folha e pro óleo essencial porém depois de já elaborado o relatório a monografia a gente conversou com os pesquisadores e houve desistência por falta de dados e a gente mandou pro setor o setor não fez contribuições em relação a a esse relatório de avaliação de todo modo a cóia tá no no tem monografia no formulário ou seja ela é uma formulação oficinal
mas ela não pode ser notificada hoje em dia porque não tem monografia farmacopa de controle de qualidade tá então vejam é a planta que a gente a gente não tem estudo para as plantas brasileiras Essa é uma das mais estudadas e falta ainda todas essas lacunas a serem preenchidas pelo menos estarem disponíveis na literatura para quem for fazer contribuições a gente pede que por favor deem uma olhada nesse guia que é o guia para elaboração de monografias do formulário de fitoterapi da farmacopéia brasileira que ele vem dizendo Olha eu preciso de todas essas informações para
caracterizar e comprovar segurança eficácia tem um webinar que tá disponível aqui quem quiser assistir que trata exatamente disso Como elaborar uma monografia é por formulário mas segue os mesmos requisitos só para terminar agora onde obter mais informações porque a gente entende que muitas dúvidas estão relacionadas ainda com a falta de leitura de todos esses documentos várias pessoas me perguntaram do dúvidas aqui no horário de intervalo de manhã que estão escritos nos documentos então por favor Leiam todos esses documentos que estão lá no Anvisa leges dentro de participação social em consultas públicas e edital de chamamento
e inclusive audiência pública tem uma página também então lá na página da audiência pública vocês também conseguem obter muitas informações tá tá tudo aí para quem não lembra a gente fez um webinar logo que concluí o guia a gente fez um webinar para explicar tudo isso lá em 2021 então tem toda essa explicação dessa mudança como é que seria tá lá nesse webinar tem todos os documentos que vão ser feitos a partir da audiência pública né vai ter um relatório da audiência pública e saiu ontem né João a gente fez um teve um convite para
publicar um artigo de revisão na revista Flora que a gente gostou muito para poder envolver mais a comunidade acadêmica Então aqui tem um resumo de todas essas mudanças vocês podem olhar é uma revista aberta vocês podem olhar e Ver um resumo também que tem Aquele quadrinho lá dizendo onde cont e o que fazer em relação a cada uma das normas onde saber mais o pedido foi harmonizar com o controle de qualidade da legislação europeia então eu quero mais detalhes Leiam Os guias da legislação europeia porque não tinha como trazer todos os guias literalmente pro nosso
guia então a gente trouxe pontos principais de cada um desse guia mas tanto que em várias partes do nosso guia a gente diz assim ó para mais informações sobre testes microbiológicos vá no guia emal para diferenciar fito de fitofármaco vá no guia emal então se puderem Leiam esses guias do Ema que se a gente pudesse fazer só assim adota-se os guia Ema seria mais fácil que ficar traduzindo e Resumindo tudo isso então tem tudo lá são milhares de guias que podem ajudar bastante no entendimento dessas mudanças ó vocês vem aqui tem o guia sobre etanol
alcal policíclicos aromáticos toda a parte de não Clínico eles TM dois guias de genotoxicidade então dá para entender bastante de regulação de fito lendo essas legislações europeias que são utilizadas por vários países no mundo quer conhecer um pouquinho mais tem todos os guias da OMS né tanto que a gente tá adotando guia de boas práticas agrícolas Gui de boas práticas de processamento e e estão disponíveis abertos aí no site da OMS também E aí eu queria terminar com esse guia aqui que foi um dos últimos a gente participou a gente tem participado de todas as
revisões de guias da UMS e esse é o guia de marcadores Como selecionar marcadores que é bastante citado no nosso guia e uma das frases deles é que a segurança e eficácia de fitoterápicos largamente depende da sua qualidade e por isso é tão importante toda essa discussão que a gente tá fazendo aqui é isso a gente agradece a paciência e está disponível agora para as perguntas do segundo bloco sobre esses outros assuntos E se sobrar tempo que faltou da outra também né Ok já temos inscrito nós já temos dois inscritos e vou chamar agora o
representante da fa Flor da vida Senor Antônio Pinto Filho acho que podia por Acho que mais dois bom dia bom dia a todos eh agradeço a palavra aqui é um prazer est reencontrando vocês alguns primeira vez outros não né Eu tô aqui representando a Federação das associações de cannabis terapêutica né então a minha pergunta é um pouco mais específica inicialmente me causou um pouco de surpresa né que a doutora disse que já tinham feito algumas consultas públicas e outras audiências onde havia sido convidado eh associações da indústria né e eu vejo que a Federação que
compõe eh que está composta mais de 50 associações de cannabis terapêutica todas regularmente instituídas A grande maioria delas com processos judiciais em curso meio que ficou um pouco de fora no começo dessa discussão mas a gente tá aqui presente a gente quer continuar eh participando cada vez mais né não estamos nos sentindo excluídos não é isso né Mas a questão é que eu acredito que a agência eh Deva dar mais atenção a esse grupo específico né porque são milhares de pessoas a Federação hoje se somando a quantidade de pacientes que ela representa na mais de
100.000 pessoas né então é um grande acervo né de de de informação da cannabis terapêutica né Que deve ser usado então a Federação como tem essa não só a questão da regulação do do fitoterapi como um todo mas especificamente da cannabis que tem uma RDC específica que eu acredito que ela vá perder eficácia inclusive vai fazer parte da minha pergunta né as associações eh através da da fa fazem fármaco vigilância eu não vi essa palavra sendo falada hoje aqui mas é algo que é muito debatido dentro do nosso círculo né porque nós estamos fazendo estávamos
fazendo e hoje a gente sai daqui com uma outra perspectiva que era de uma autorregulação né porque o O que as associações fazem muito do que foi dito pela senhora hoje é feito pelas associações né esse controle as associações em dentro dessa autorregulação pegaram como Norte a RDC 3 A RDC 26 né a RDC 18 da farmácia Viva né e outras rdcs que se que a gente acredita que se aplicam para facilitar esse processo de industrialização desse fitoterápico específico né então é feito fármaco vigilância é feito acompanhamento com pacientes é um acervo gigantesco que possa
que dá tempo de ser incluí como sugestão orientação né nessa nesse debate e fica o meu questionamento do seguinte que como houve a inclusão da cannabis na farmacopeia brasileira agora na sétima Edição né a gente entende que vai ser aplicado a RDC 26 para ela e a pergunta minha que fica que a RDC 327 ela perderia um pouco a eficácia ou ela ficaria específica apenas para o insumo foi importado ou aplicaria a produção do insumo através da RDC 26 e poderia ser incluído na 327 dentro daquelas especificações né agradeço a oportunidade Obrigado convidamos agora o
representante da associação Flor da vida Sr Túlio Santos eh bom dia a todos e todas é uma alegria a gente tá aqui eh eu trabalho na associação for da vida representa então uma associação de pacientes que produz a o remédio aqui no país a gente planta maconha extrai o remédio distribuímos para mais de 12.000 famílias no país todo né com mais de 5 anos de experiência fazendo a controle de qualidade tanto no cultivo quanto nas as boas práticas de produção no laboratório Ah então é eh pego um pouco das palavras do meu amigo meu colega
de ativismo Dr Antônio né muito bom a gente tá aqui eh mas e gostaria de chamar esse olhar né ter um olhar diferente para essas associações de pacientes que produzem o próprio remédio né Afinal nós não somos empresas nós temos outras finalidades qual seja né promover a saúde com essa planta né é uma planta que é tão utilizada há milhares de anos por vários vários povos em todo o mundo e aí eu trago um pouco essa pergunta mais específica sobre a relação da maconha como enquanto um produto tradicional fitoterápico né a gente teve agora A
reinserção da cannabis sativa na farmacopeia né ela esteve na primeira edição em 26 depois ser tiada em 40 pós uma perseguição racista da planta é uma planta que foi muito utilizada eu acho que tem um documentário muito curioso chama dirijo tem no YouTube 13 minutos mostra povos indígenas na Amazônia aqui no nosso país que utilizavam essa planta dentro da comunidade que foi eles Foi retirada né E com essa retirada dessa planta eles passaram a consumir álcool e se tem uma consequência assombrosa dentro dessa comunidade Então queria entendu um pouco assim qual essa inserção né a
inserção da da cannabis na farmacopeia foi pós a abertura da consulta pública Então se vai ser alterado o entendimento da cannabis né na na instrução normativa se vai ter algum movimento nesse sentido e se não for né Qual que é a justificativa dela não ser compreendida enquanto um produto tradicional fitoterápico pois assim o é é utilizado né centenas de anos aqui no nosso país milhares de anos em outros países né Então queria entender um pouquinho como que tá esse movimento porque a as pessoas hoje essas associações já existem produzem no país produzem e elas tentam
se adequar com o que tem de legislação mas a gente tem que colocar uma legislação possível né E a vida não pode esperar gente muito Obrigado e um ótimo dia a todos para a última manifestação desse bloco convido a representante da bequi senora Valéria rebeschini Olá bom dia a todos muito obrigada pela oportunidade a discussão está sendo ótima muito esclarecedora e eu acho que canab ficou pro segundo tema né gente como não poderia deixar de ser eu tenho uma dúvida aqui eh especificamente né nesse contexto da do produto de cannabis nós teremos que definir os
tipos de extrato né padronizado quantificado e outros e aí eh eu queria saber um pouquinho como que vai ficar essa com a submissão da autorização de da da autorização de cannabis né e dependendo da combinação de canabinoides e processos podemos ter diferentes tipos de extratos eh como que ficaria esse esse tipo de produto né e como que a gente poderia passar isso depois pros pacientes pros médicos né a gente queria entender um pouquinho e também eh quando a empresa eh importar o o o insumo né Deve considerar a lista de agrotóxico do país né do
importador eh e qual que deve qual o padrão que ela deve seguir nesse caso eu falei direitinho Élder Tem mais alguma dúvida aqui qualquer coisa pode me Completar obrigada obrigado pelas considerações e manifestações eh Vamos lá eh Antônio Filho obrigado aí pelas suas considerações Eh entendi o que você colocou enquanto a associação eh não tenha feito parte dessa discussão eh acho que quando a gente lê o relatório de air eh é possível verificar ali a gente comentou aqui também que essas discussões elas já T mais de 10 anos que estão sendo feitas junto com com
o setor regulado né então isso eh envolve a a questão dos fitoterápicos de forma eh bastante Ampla eh e uma discussão considerando os produtos que são industrializados né né então a gente já vem discutindo isso ah desde ali de 2012 na verdade desde 2010 né Ana basicamente a gente já tem considerações foi quando a gente teve a outra RDC eh a gente já tinha solicitações referentes a essa mudança que tá sendo feita agora e que foi sendo amadurecida no decorrer dos anos então Eh ela é uma discussão que tá muito focada eh como hoje as
CPS estão relacionados aos produtos que são industrializados ah sobre a questão eh da farmacovigilância Antônio ela não foi mencionada aqui hoje porque ela tem uma Norma própria Então os fitoterápicos produtos de cannabis enfim estão sujeitos a a farmacovigilância sim mas existe uma Norma específica que não tá sendo tratada nesse momento eh da consulta pública por isso que você não ouviu a gente falar esse termo aqui mas ela se aplica sim se você for ler ali a a a P eh 1290 ela vai falar e vai fazer remissão à Norma específica que trata da farmacovigilância tamanho
a sua importância e relevância ah sobre a questão da inclusão eh da cannabis na farmacopeia brasileira e essa questão que você coloca aí eh no no seu entendimento de como vai ficar iso se os produtos serão submetidos como eh medicamentos ou como produto de cannabis seguindo qual norma ah a gente tem hoje A a situação que é bastante Clara se a gente ler o air também de produto de cannabis fugindo aqui do do nosso tema de fitoterápicos um pouco mais tentando explicar essa questão a gente não tem ainda dados que sejam confirmatórios de eficácia eh
para boa parte dessas indicações Então os produtos ainda precisam A grande maioria deles entrar com pedido com uma autorização sanitária com base na RDC 327 a partir do momento em que a gente tem informações que sejam confirmatórias para as indicações terapêuticas específicas Eh esses produtos podem entrar com pedido de registro aí como medicamento fitoterápico se for o caso eh de um de um extrato enfim eh seguindo aí a a nova Norma quando ela tiver já disponível ou como medicamento específico seguindo a atual RDC 24 de 2011 ou a norma que vier a atualizar essa essa
essa resolução eh Então hoje a gente continua eh a princípio eh com a questão da possibilidade de enquadramento tanto como medicamento pros produtos obtidos a partir de cannabis quanto como produto de cannabis considerando a eminente aí revisão da RDC 327 também que está sendo discutida em breve a gente espera que seja aprovada também a consulta pública e a gente tem a oportunidade de fazer a revisão dessa da dessa desse marco regulatório Então as duas possibilidades continuam eh atendendo sempre aquele prazo que tá estabelecido na Norma vocês sabem como eh a gente trouxe ali no relatório
de de a aprovado pela diretoria colegiada que há uma perspectiva uma possibilidade que vem sendo discutida que vai ser discutida na consulta pública de ampliação eh com a possibilidade de renovação por mais 5 anos do prazo de validade da autorização sanitária para que esses estudos sejam então concluídos e as empresas façam a solicitação e a migração desses produtos de cannabis então paraa categoria de medicamentos Então as duas continuam existindo e a inclusão ah da monografia da droga vegetal da da cannabis das inflorescências de cannabis na eh farmacopeia brasileira ela vai dar suporte ao início do
processo seja em relação a um medicamento fitoterápico a um produto de cannabis que é embasar o controle da qualidade daquele primeiro ali que é a matéria prima vegetal que é a droga vegetal que vai dar origem depois a um estrato que depois vai ser utilizado na fabricação de um produto Então ela é o início ali daquele processo e eh eh por isso que é pensado dessa forma e foi trabalhado dessa forma por uma colega Nossa durante o seu doutorado e a monografia foi incluída e na farmacopeia brasileira e a gente tá muito contente com isso
Esperamos que isso eh possibilite depois que a gente consiga avançar também ah dentro da farmacopéia brasileira estabelecendo monografias para derivados enfim ã até o fitofármaco canabidiol mais à frente eh para que a gente consiga também eh estabelecer padrões em relação à qualidade para esses produtos enquanto produto de cannabis ou enquanto medicamento fitoterápico ou medicamento específico obtido a partir também de derivados de cannabis então Eh permanecem os dois Ah o que muda em relação à inclusão na farmacopéia brasileira da monografia que ela se torna obrigatória então pro controle da droga vegetal que é o início do
processo aquela monografia precisa ser seguida aí eh quer que eu fale da segunda já Ana a gente teve a a manifestação do Túlio que também questiona a questão da inclusão da monografia das inflorescências de cannabis ativa na farmacopeia brasileira e a restrição que tá prevista na consulta pública na CP 1291 em relação à a cannabis ativa se isso seria revisto enfim eh não ela não tem uma vinculação direta Ah o fato de a gente ter uma monografia da cannabis ativa na farmacopea brasileira não muda o fato da portaria 344 trazê-la como planta eh de uso
proscrito com as exceções que estão ali previstas obviamente dos produtos que são autorizados pela Anvisa seja como medicamento seja como produto de Caná canis ou os produtos que são importados também com finalidade de uso eh medicinal né obtidos a partir da cannabis ativa então eh a gente continua tendo eh um olhar eh acerca do controle Dessa espécie vegetal eh a gente tem thc ali presente a gente tá falando da cannabis ativa a gente não tá falando de nenhum quimiotipo específico talvez quando isso foi incorporado não sei em uma revisão da 344 a gente tem a
possibilidade de fazer uma rediscussão desse ponto mas o fato é eh hoje eh o fato de fazer uma restrição em relação a a a cannabis ali para um produto tradicional fitoterápico não muda a essência da gente não ter ainda informações que sejam confirmatórias de eficácia ainda com base na tradicionalidade sobretudo considerando as doenças que são hoje utilizadas em que esses produtos de cannabis são utilizados que são doenças graves eh que são doenças na maioria das vezes sem tratamentos eh disponíveis aí eh eh na farmacoterapêutica convencional eh e que eh a gente não teria a possibilidade
de colocar esse produto como produto eh isento de prescrição médica isento de acompanhamento e até mesmo pela portaria 344 a gente não teria a possibilidade de deixar de estabelecer um controle relativo a esse produto a menos que essa Norma mude eh e em que Pese essa essa restrição não estivesse ali presente isso não muda o fato da gente não ter informações acerca da tradicionalidade de uso dessa planta desses derivados para essas indicações terapêuticas específicas Considerando o tempo de uso considerando a o que A Norma traz em relação a essas considerações que vem lá das recomendações
da UMS então que a gente não vai eh são para doenças ou condições de saúde eh que são facilmente identificáveis tratáveis e e e e acompanhadas né enfim eh mas a gente vê aí um advento aí de ah pesquisas que vêm sendo realizadas apesar da gente não tem ainda pesquisas sejam confirmatórias da eficácia de boa parte dessas dessas indicações e futuramente pode ser que a gente consiga eh conversar melhor sobre isso mas hoje não tem dados suficientes que nos permitam fazer essa mudança em termos de restrição relacionada a produto tradicional fitoterápico e eh derivado de
cannabis porque a gente não tem dado suficiente sobre segurança e sobre a eficácia de boa parte desses derivados para boa parte dessas condições clínicas Ana se você quiser complementar Por favor fica à vontade o João já colocou quase tudo mas é só para lembrar de uma coisa o produto tradicional é aquele que é utilizado por pelo menos 30 anos naquele ins somativo específico para indicação específica primeiro cannabis não é utilizado para doenças de baixa gravidade que é o primeiro item de de de autorização como produto tradicional mas uma outra coisa que pega muito é que
a cannabis que é utilizada lá Desde o tempo de Jesus Cristo P fala tem 4000 tempos de uso não é a mesma cannabis de hoje essas espécies elas foram evoluindo para concentrar-se em quimiotipos e variedades específicas que tem concentrações de canabinoides muito diferentes daquela utilizada lá atrás então não tenho dados não clínicos e clínicos para colocar simplificações como medicamentos pto terápico e não tenham 30 anos de uso de nenhuma dessas desses quimiotipos ou variedades que são utilizadas hoje em dia então a cannabis não preenche nenhum dos é documentado pode ter de forma oral pode ter
utilizado em determinado laboratório Mas isso não está publicado na literatura porque é aquilo que a gente tava conversando aqui nas legislações eu tenho que ter as três publicações que digam que esse quimiotipo específico tem uso para aquela indicação de baixa gravidade específica a pelo menos 30 anos então ela não preenche esses requisitos nesse momento deixa eu ver uhum é mais uma dessas que quem sabe daqui a 30 anos vai estar bem diferente e só uma coisa que eu queria adicionar que a gente fala em todas as palestra gente pra Equipe técnica de registro a cabis
é a mesma coisa de abacaxi de guaco de espinheira santa a norma é a mesma se houver o dado ele vai ser registrado como medicamento a gente tanto tentou simplificar que criou a 32 27 para dizer ó enquanto não tem esse dado vão por aqui vão produzindo dado para chegar em medicamento Tá mas é é é mais uma das plantas que Ainda faltam muitos dados Para comprovar toda a segurança eficaz Ah sim tem tem a pergunta e mas só só para complementar que eh O que a 327 faz em relação à possibilidade de produto de
cannabis é infinitamente uma facilitação em relação a produto tradicional fitoterápico tá então eh O que a abertura que é dada pela 327 eh se a pessoa não consegue eh atender aqueles requisitos ela não consegue cumprir um décimo do que tá estabelecido para produto tradicional fitoterápico então Eh eh é uma discussão assim que eu eu entendo a colocação de vocês em termos do do histórico do estigma que ficou em relação à planta mas a gente aqui trata ela como qualquer outra planta e eh tanto que como a Ana colocou a gente traz uma uma Norma e
uma facilitação para ela que vai além do que tá estabelecido por um produto tradicional fitoterápico até Uhum é mais simples até do que se fosse ptf né eh e aí só lembrando as normas que a gente está discutindo aqui hoje são de registro de medicamento a gente gostaria queria que fosse tudo em conjunto né a 37 tivesse em discussão mas infelizmente ainda não são então a gente tá discutindo as específicas de registro de fitos e onde eles impactam na cannabis no no controle de qualidade porque eu vou ter que seguir realmente Valéria todas as mudanças
que estão sendo previstas para qualquer planta se se implantarão também para afito ou para cannabis E aí se implantam também todas os prazos que serão dadas todas as discussões que estão sendo feitas eu vou tratar o extrato de cân Bis como um extrato de bodo extrato de qualquer outra coisa eu preciso definir se ela é padronizado quantificado ou outros e aí talvez seja mais fácil porque já tenho muitos dados pro cbd se o cbd for considerado a substância responsável pela atividade terapêutica Talvez consiga comparar com o extrato vegetal e já tentar uma padronização um estrato
como se fosse padronizado para os outros substâncias que podem ser utilizadas no controle vai ser feita toda essa discussão como do mesmo modo que qualquer outra planta e aí para quem tá solicitando as autorizações sanitárias agora vai ter o mesmo prazo de qualquer outra planta que aquele prazo lá eu continuo fazendo pela 26 durante 3 anos tá então esse tempo para você se arem também aí na canabis Só lembrando também né que a RDC 327 ela é uma Norma que é focada no cannabidiol né então ela fala de predominantemente canabidiol então é importante avaliar o
produto que tá sendo desenvolvido a questão do racional Clínico que tá sendo montado eh eh eh considerando esse produto e o desenvolvimento desse produto para que a gente consiga fazer a adequada classificação aí desse eh estrato at e entre aqueles três conceitos Tá certo quando vocês quando as empresas montam um racional para apresentar um pedido de autorização sanitária para Anvisa Ela Tem que apresentar então eh uma série de dados e de estudos eh colocando ali a o objetivo é desenvolver então estudos que para que esse produto no futuro possa ser empregado para determinada indicação de
uso né considerando então a a o conteúdo dos canabinoides ali presente a forma de apresentação a via de administração acho que era isso né Posso comentar só mais uma coisa vocês vão ver até lá no Leiam esses documentos que a gente comentou todos esses pontos lá essa mudança aqui é entendida como um facilitador pro pros produtos obtidos da canis ativa porque vários produtos que vão tem pedido de autorização sanitária a gente barra porque eles não cumprem esses requisitos que são diferenciados aqui na legislação brasileira então a gente entende que na porque os produtos vem de
fora eles segue essa legislação que é praticada em todo canto Então vem para cá ele tem que ter essa padronização de marcadores eu tenho que não diluir ou não misturar extrato dependendo da situação de cada um dos produtos então Vai facilitar porque o produto vai poder vir sem ter que fazer todos os ajustes que hoje são necessários chamando o próximo bloco convido o senhor Leandro Medeiros representante da Universidade Católica de Pernambuco e do Conselho Federal de [Música] farmácia Bom dia a todos todas e todos Parabéns pessoal pelo trabalho e dando segmento aqui eu queria um
esclarecimento só a respeito da eh Que tipo de de qualidade deve ter o ensaio Clínico para que ele possa ser considerado válido durante uma uma avaliação de de eficácia segurança né E aí eu me refiro Claro é necessário que o ensaio Clínico ele traga os dados detalhados do produto eu eu entendi que isso é um ponto Fundamental e é uma grande limitação quando a gente observa os estudos de fato eles não trazem Às vezes o que tem exatamente com que avaliado mas eu eu me refiro até do ponto de vista da da da da qualidade
de uma forma um pouco mais ampliada por exemplo risco de vieses eh número de participantes enfim do ponto de vista do desenho do estudo o que que seria ao olhar da Anvisa uma um ensaio válido para poder fazer essa comprovação da eficácia segurança é isso [Música] obrigado não tem não temos mais nenhuma manifestação poss responder muito obrigada lean prazer ter vocês aqui do cff com a gente eh e essa é uma questão que a gente discutiu demais Desde da RDC 48 né João tinha gente que queria dizer não só vale se for estudo Clínico padrão
padronizado tudo certinho mas a gente sabe que não tem pra maioria dos filhos tanto que no na in4 que é o guia hoje a gente tentou detalhar dizendo até assim sendo válidos Eles serão considerados e nesse novo a proposta de guia tá mais detalhado um pouco mais mas na prática se eu vou fazer um estudo Clínico se eu vou registrar como medicamento F terápico eu tenho que seguir todas as normas gerais de estudos clínicos a gente tem Norma específica pro não Clínico pro Clínico não tem Norma específica não segue A Regra geral a RDC acabou
de ser republicada em Dezembro acho que é 945 de 2024 e ela é muito uma harmonização com as questões do I Então adotam-se todos os guias a série e do iich de estudos clínicos para medicamentos então eu vou seguir todos os requisitos o ideal é que ele seja representativo ele tem uma boa análise estatística que ela comprove para aquele informativo específico então é o mesmo requisito que eu vou considerar para um medicamento sintético é outra coisa que pergunta muita gente ah mas já tem publicado naquela revista o estudo Clínico de fase três a gente vai
ver esse estudo ele não é suficiente pro registro a legislação diz eu tenho que ter estudos completos eu preciso dos estudos de fase um de fase dois Se ainda for desse tipo pode ter estudos mistos mas eu tenho que ter todas as etapas de comprovação que são previstas na legislação de estudos clínicos eh a gente fez um webinar com as associações né falando do não Clínico a gente quer fazer muito em breve um já tem um webinar sobre pesquisa clínica de cannabis que é são os mesmos requisitos para qualquer outro fitoterápico e vai pretende fazer
em breve de não Clínico né logo que a gente tiver tempo eh e de forma geral não tendo Norma específica vai seguir a regra geral que acabou de ser republicada em adição à Regra geral do mesmo jeito para fito sempre tem um puxadinho então tem o livro da OMS que foi publicado em 2008 foi traduzido pela a o Ministério da Saúde a partir dos pesquisadores da UnB que é sobre pesquisa clínica de fito que ele vem dizendo olha nisso aqui eu posso facilitar em tal ponto nisso aqui eu preciso que você tenha mais dados em
relação à qualidade em relação ao medicamento sintético então ele vem detalhando um pouco e a gente tenta Trazer isso para as orientações que estão no guia então o guia tem um pouco de detalhamento Mas você tem que ir na 945 que é geral de medicamentos e tem que ir no guia da OMS também é lá que tem a questão de que do de onde eu posso apresentar dados de literatura em vez de fazer todo um estudo novo né porque pode ser feito uma revisão E se esses dados já tiverem disponíveis na literatura eles podem ser
apresentado a dificuldade é não tem esses dados Eu tenho um estudo Clínico mas o estrato não tá bem caracterizado na maioria dos casos é isso acontece e a gente não consegue utilizar tanto que naquele guia lá da farmacopeia do de como elaborar monografias para farmacopeia a gente tentou elaborar um documento Olha tem que ter minimamente isso tem que descrever Qual o ifv tem que ter minimamente essas informações para que elas possam ser utilizadas porque como eu comentei o Capim Santo tem 50.000 artigos 50.000 artigos científicos de segurança eficácia não é só poras coisas e a
gente não consegue obter todos os dados que a gente quer pro zif vz porque ou os artigos não informam os dados ou eles são totalmente pulverizados não são do mesmo informativo e E essas são informações que a gente tem como corrigir né nas publicações de agora pra frente então é importantíssimo que eh a enquanto enfim pesquisad ores quem trabalha mais diretamente também como revisor desse texos cobrem essa qualificação desse material que é submetido a esse estudos nessas publicações para que de fato essas informações mais à frente elas possam ser utilizadas e elas tenham uma relevância
paraa sociedade de de forma mais Ampla né e virar um produto agregado aí mas eh Leandro só voltando em alguns aspectos assim do do que você trouxe também para acrescentar no que a Ana já falou eh a gente vai ter por exemplo assim quando a gente vai discutir a questão de um de um n de uma representatividade isso tudo vai passar pela indicação terapêutica do produto pelos desfechos né que vão ser eh eh avaliados aí enquanto desfecho primário desfecho secundário se a gente tiver uma condição que é mais rara a gente não tem como cobrar
então um um um n que seja expressivo que a gente não vai ter eh isso nunca emem em um estudo então assim essas ponderações elas são feitas e a gente trás desses guias eh eh tanto de ch né O que tá sendo internalizado aqui por nós também eh dados que são importantes e tem esse da UMS que faz traz alguma flexibilidade em relação aos fitoterápicos e que a gente também já aceita ele de forma bastante Clara aí desde 2014 então há mais de 10 anos a gente já tem essas considerações então na prática não tem
como a gente definir aqui um um um um padrão que vai se aplicar a qualquer caso ou uma média dos casos a gente precisa fazer uma avaliação caso a caso eh mesmo porque como a gente colocou aqui em algumas situações dá pra gente aproveitar esses dados da literatura né então a gente não consegue respaldar de repente todo o registro do produto Com base no dado da literatura mas aquele dado de literatura permite que a gente pule algumas etapas consiga consiga avançar nas investigações complementando as informações que estão faltantes Caiara Ah eu quero agradecer também aqui
a presença me foi passado aqui da Mayara Rezende também representando a sociedade brasileira de plantas medicinais obrigado viu pela presença aqui conosco temos mais alguma inscrição que tem uma pergunta da Mayara aqui no no próprio no no CR code você quer vir fazer aqui ou você prefere que leia aqui você quer ler quer ler tá f eh então tem mais três perguntas aqui além daquelas que a gente já fez mais duas uma seria exatamente da Maiara eh gostaria de saber quais serão os tipos de dados sobre evidência de mundo real que serão aceitos para fito
sabemos da existência do guia 64 Mas isso não ficou Claro na consulta pública 1290 teremos alguma Norma complementar o que será atualizado para a área fito temos a norma complementar que é a norma Geral de registro de Med que é a 948 que ela traz a previsão da utilização de dados de mundo real né e ele tá lá dentro dos dados técnicos científicos que podem ser utilizados ou que deve ser seguido é exatamente o que tá no guia 64 e por isso a gente não precisa ter orientações específicas porque já tá na Norma geral e
a orientação geral já tá no guia 64 só complementando Maiara como essa questão de utilização de dados de mundo real é bastante novo para todo mundo pras autoridades reguladoras de forma também bastante eh além do guia 64 e existe um grupo de trabalho que foi montado tem uma portaria inclusive que defina você tá fazendo parte então eh a gente conta muito com o apoio do grupo de trabalho que tá formalizado hoje junto da gerência Geral de medicamentos porque o que a gente tem colocado e tem estimulado é que todos os protocolos de estudos com dados
de mundo real eh eles precisam devem passar por avaliação né e considerações desse grupo para que a gente tenha oportunidade reguladores pesquisadores e outras pessoas com experiência nessa avaliação eh consigam trazer considerações para aquele protocolo de estudo para que a gente consiga de fato Aproveitar esses dados aí considerando os produtos que já estão sendo utilizados então Eh eh a gente também segue aprendendo em relação a aos dados eh de mundo real e a a nossa RDC ela na verdade vem trazer algumas idades relacionadas a fitoterápicos mas a RDC 948 que foi publicada no final do
ano passado ela já tá já traz os requisitos Gerais e ela já traz essa previsão da possibilidade de aplicação desses dados de vida real eh para fitoterápicos eu não sei exatamente se isso seria factível para boa parte deles porque considerando que a gente tem dados de literatura talvez essa continue sendo uma uma possibilidade eh eh mais factível ou mais interessante em relação ao fitoterapia mas a gente sabe de condições como a própria cannabis ativa em que talvez a utilização desses dados os protocolos com estudos de dados de vida real possam ser aplicáveis possam ser interessantes
nesse momento tem mais uma tem mais uma só aqui na contribuição por meio do do có de baras que é daiano Cadê ela queria fazer comentários em relação à pergunta que foi feita sobre a utilização da substância isolada quando ela é relacionada com atividade terapêutica a pergunta feita sobre aproveitar dados de constituintes ou grupos para classificar me trouxe à memória o caso dos grupos hidró antracênicos [Música] só um minutinho presentes no cene frângula cáscara sagrada onde os dados fartos existentes para uma planta puderam ser utilizados para classificar os demais que cito Aim só um exemplo
não é comum mas é um exemplo que existe para ilustrar mostra dados feitos para o extrato como enfatizado pela Cecília mas nesse caso específico ampliado para outros extratos Mas de fato entendo que muito cas caso como mencionado pelo João você quer complementar Eliana Uhum Então nesse caso os dados de uma planta puderam ser utilizados para classificar aquele marcador como eh substância responsável pela atividade terapêutica em outras plantas Então existe isso e depende do dado sempre vai depender do dado que existe das espécies que tiverem discussão né mas Há a possibilidade parece que terminamos a gente
achou que até 6 hor da noite terminamos não temos mais inscritos nenhuma outra manifestação aqui não são essas que a gente tá lendo tem mais um deixa Ah tá deixa eu atualizar Então chegou mesmo mais um respostas pergunta da gisl presidente da pefisa pelo que avaliamos preliminarmente existem opções de regist simplificado nas monografias propostas que coincidem com as opções do formulário nesse caso a notificação é mandatória correto ainda assim a monografia seria publicada eh a gente deixou os dados para ver se aparecem mais informações se no fim todas as informações que embasarem foram exatamente igual
mesmo ifv para as mesmas indicações no formulário para notificação e no registro simplificado Então vai prevalecer o formulário sempre que que a informação for exatamente igual porque às vezes eu posso ter um IFA V que tá em um para uma indicação e outra indicação em outra dependendo porque o formulário foi em tempos diferentes foi feito por pessoas diferentes Então quando for tudo igual prevalece o formulário se tiver ou um ifv diferente Ou uma indicação diferente Ou talvez até at uma restrição diferente pode ser que fique no registro simplificado a gente vai avaliar quando conseguir reunir
isso tudo e a gente fica muito feliz com a sociedade com a presença da Sociedade Brasileira de plantas medicinais pedindo para todas as sociedades científicas sociedades de cannabis todo mundo contribuir nesses documentos para que realmente a gente consiga levantar todos esses dados e tenha as monografias e relatórios de de avaliação do registro simplificado mais completos possíveis tá muito obrigada Vou atualizar de novo chegou Marão Prados então eu quero agradecer aqui eh muito a além aqui da minha equipe da gmesp eh Raquel Rogério todos os colegas que participaram das discussões das revisões desses documentos e que
não puderam estar aqui presentes hoje acompanhando essa audiência pública conosco mas principalmente a Ana que liderou aí esse processo de visão a discussão e a elaboração desses documentos a organização dessa audiência pública junto com também a a cevec que muito obrigado pelo apoio de vocês Eh quero agradecer também o apoio das reg que nos auxiliou muito nesse processo de construção desde a elaboração eh do relatório de análise de impacto regulatório e até agora né Na hora de disponibilizar as consultas públicas e na hora da gente fazer a consolidação também né então de trazer as contribuições
de vocês até a gente a gente conta muito com o apoio deles eu agradeço muito então Agradeço também a todos vocês eh a todos que puderam estar aqui presentes também que foram convidados diretamente por nós representantes do Ministério da Saúde da Fiocruz da Sociedade Brasileira de plantas medicinais Conselho Federal de farmácia Muito obrigado muito obrigado aos representantes das associações do setor regulado acho que se também não fosse a insistência de vocês e a possibilidade de gente a gente fazer um um diálogo Maduro e construtivo de fato durante todos esses anos a gente não chegaria a
esse momento a essa proposta a isso que tá sendo discutido nesse momento então Eh boa parte desse trabalho do que tá sendo colocado aqui dos elogios que vocês nos fizeram ali eu também reporto ele a a vocês que participaram conosco desde o início dessa discussão e a gente conta muito com as contribuições de todos vocês lá nos formulários específicos de cada uma das consultas públicas eh não deixem de observar os prazos para para que não não percam aí os prazos como a Ana apontou ali a gente tem prazos diferentes em cada um desses desses documentos
para contribuições naquele naquela notícia a gente tem o link mas a gente também fala um pouquinho sobre esse prazo para que ninguém se perca nisso então muito obrigado pelas discussões aqui no dia de hoje também e pela presença de todos vocês obrigado [Aplausos] [Música] ninguém morreu [Música]
Похожие видео
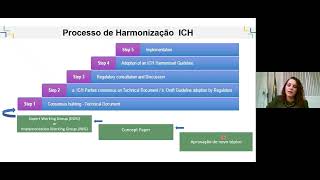
1:32:28
Webinar - Diálogos Regulatórios Internacio...
Agência Nacional de Vigilância Sanitária
102 views

1:22:15
AUDIÊNCIA PÚBLICA MODERNIZAÇÃO DO REGIMENT...
Agência Nacional de Vigilância Sanitária
324 views

2:02:08
1ª Reunião Ordinária Pública da Dicol - 2025
Agência Nacional de Vigilância Sanitária
996 views

1:53:26
Webinar - Direito Sanitário - STF: como as...
Agência Nacional de Vigilância Sanitária
50 views

4:53
Details on U.S. peace talks with Russia ov...
CBS News
4,389 views

2:32:16
Webinar - Segurança do Paciente nos serviç...
Agência Nacional de Vigilância Sanitária
268 views

4:17:45
Workshop "25 anos de Regulação de Medicame...
Agência Nacional de Vigilância Sanitária
95 views

57:44
Webinar - Explorando Tópicos do Edital de ...
Agência Nacional de Vigilância Sanitária
161 views

54:16
Cerimonia de Posse
Agência Nacional de Vigilância Sanitária
408 views

2:31:20
Seminário CADIFA 2024 - Parte da manhã
Agência Nacional de Vigilância Sanitária
444 views

5:37
Trump administration continues mass layoff...
MSNBC
19,121 views

20:08
Fernando Schüler: "Esse e um governo que e...
Band Jornalismo
179 views

1:57:40
sessão ordinária do dia 10 de fevereiro de...
Câmara Municipal de Macatuba
63 views

7:38
Vídeo 2 Forma de condução do estudo de v...
Agência Nacional de Vigilância Sanitária
476 views

2:48:16
Seminário CADIFA 2024 - Parte da Tarde
Agência Nacional de Vigilância Sanitária
263 views

7:53
Supreme Court Considers Trump’s Power, and...
New York Times Podcasts
3,218 views

6:00
Vídeo 3 - Avaliação das leituras de branqu...
Agência Nacional de Vigilância Sanitária
259 views

7:17:25
25ª Reunião Ordinária Pública da Dicol
Agência Nacional de Vigilância Sanitária
2,048 views

2:09
Trump administration tries to bring back f...
ABC7
960 views

3:11
UK PM Keir Starmer Shocks U.S, Europe; Dec...
Oneindia News
4,393 views