Episódio 12 - Como funcionam as coisas? (Mecanismo de Reação)
33.09k views2160 WordsCopy TextShare
Universidade da Química
Nassa aula vemos os conceitos básicos referentes a mecanismos de reação, sob o ponto de vista da cin...
Video Transcript:
[Música] Olá pessoal sejam bem-vindos a mais um vídeo da Universidade da química e o Episódio de hoje tem por tema como as coisas acontecem na verdade no episódio de hoje eu vou falar um pouco sobre mecanismos de reação ou Mais especificamente Qual o papel da lei de velocidade da reação para termos uma ideia do mecanismo de uma reação é sobre isso que a gente vai falar no episódio de hoje mas antes de tudo nós precisamos entender o que que é um mecanismo reacional o que que é o mecanismo de uma reação eu posso definir mecanismo
como sendo o conjunto de etapas elementares que quando somadas fornecem a reação Global nós vimos no episódio anterior o que eram essas etapas elementares ou etapas moleculares o mecanismo na verdade é o conjunto dessas etapas moleculares essas etapas elementares vocês devem estar acostumados com os mecanismos em reações orgânicas Inclusive a primeira aula do Mega química o quadro novo aqui do canal foi a respeito de mecanismos de reações mecanismos de reações de substituição nucleofílica se você tiver alguma dúvida eu vou deixar o link aqui na descrição do vídeo Mas então o objetivo da aula não é
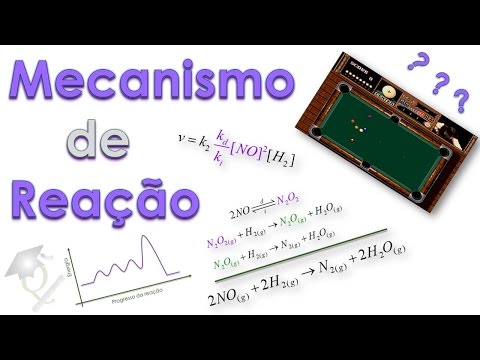
necessariamente tratarmos mecanismos individuais mas passar para vocês a ideia de como a lei de velocidade é o principal indicativo que nós temos na hora de propor o mecanismo para entendermos mais ou menos como funciona o mecanismo imagine essas duas situações aqui eu tenho uma mesa de sinuc com uma mesa de bilhar extraída lá do velho bom Side Pocket do Mega Drive Aqui nós temos a representação do que seria o início da reação né apenas os reagentes e aqui o final seria os produtos o que que é o mecanismo da reação o mecanismo equivale perguntar a
você o seguinte Qual foi o caminho onde a bola branca bateu quais bolas bateram com outras bolas a ponto de fazer com que essa situação Inicial se convertesse nessa situação final entenderam uma coisa ter os regentes os produtos é ter o estado Inicial e o estado final o mecanismo é o que ocorreu ali para transformar os reagentes em produtos e aí já dá para termos uma ideia de que propor mecanismos não é nada fácil aliás propor mecanismos é uma coisa e imaginada uma coisa e idealizada nós não temos como saber exatamente qual é o mecanismo
nós temos vários indícios para escolher um mecanismo em preferência de outro mas saber como não tem para imaginarmos Portanto o mecanismo para imaginarmos propormos um bom mecanismo é necessário ter um pouco de imaginação intuição química e bom senso porque a tarefa não é fácil imagina nesse caso você saberia me descrever o caminho percorrido pela bola branca para fazer com que essa configuração Inicial fosse convertida nessa configuração final bom eu não saberia responder o caminho específico nesse caso nós podemos ver porque temos o vídeo mas uma reação química nós não temos um vídeo passo a passo
de como ela ocorre por isso é necessário termos bom senso termos um pré conhecimento químico temos uma boa intuição na hora de propor os mecanismos E como eu disse o ponto principal a nossa guia mestra na hora de determinar o mecanismo é a lei de velocidade Global porque a lei de velocidade Global ela é um reflexo de como a reação ocorre nós vimos também no episódio anterior o conceito de etapa lenta e Vimos que a etapa lenta de uma reação é a etapa determinante da reação Inclusive a lei de velocidade da Etapa lenta é a
lei de velocidade Global da reação Porque é ela que determina a velocidade da reação Então vamos ver aqui dois exemplos um mais simples na hora de propor o mecanismo outro um pouco mais complexo mas nos dois casos vamos ver como que o mecanismo tem que estar lincado tem que estar correlacionado com a lei de velocidade primeiro caso nós temos essa reação Aqui nós temos o NO2 reagindo com o F2 com gás fluor formando o fn2 como que é esse mecanismo primeiro tem que olhar para a lei de velocidade a lei de velocidade me diz que
é uma reação de ordem dois porém ordem 1 em relação ao NO2 ordem 1 em relação ao F2 isso de cara me diz que essa reação não ocorre numa única etapa que essa reação Global na verdade é o somatório de o conjunto de reações elementares prévias e a etapa lenda da reação contém uma molécula de NO2 e uma molécula de F2 Afinal para etapas elementares o coeficiente estequiométrico equivale oo expoente da lei de velocidade então um mecanismo razoável proposto nesse caso é esse daqui um NO2 reage com F2 forma o fn2 e gera um átomo
de fluo como intermediário o intermediário por sua vez é uma espécie bem reativa ele vai reagir com NO2 E vai formar outra molécula de fn2 de modo que no final na reação Global eu tenho formado duas moléculas ou melhor 2 mols de fn2 Esse é um mecanismo bem razoável e o mecanismo que está de acordo com a lei de velocidade da reação Então vamos ver agora um outro exemplo como é necessário o bom senso químico na hora de propor o mecanismo eu tenho uma outra reação nesse caso seria o no o óxido nítrico reagindo com
o hidrogênio molecular para formar nitrogênio molecular e água o mecanismo proposto para essa reação é o seguinte tenho 2no reagindo com H2 vai formar o n2ox uma vez que a lei de velocidade é uma reação de ordem três onde nós temos ordem dois em relação ao no em relação à concentração do no e Ordem um em relação à concentração do H2 está muito coerente com essa primeira reação que é portanto etapa lenta da reação aquela que vai determinar que vai ter a cara da lei de velocidade Global até aí Tudo bem não tem problema nenhum
não tem nada de errado mas aqui tem algo esquisito tem algo estranho que uma vez você tendo bom senso químico você vai determinar nota essa lei de velocidade ela indica Ela diz que essa reação é uma reação ter molecular que ela ocorre através do Choque ao mesmo tempo de três moléculas Agora imagina um sistema aberto num sistema tridimensional aberto onde três moléculas se chocam ao mesmo tempo a probabilidade disso acontecer é muito baixa eu falei no episódio anterior que reações ter moleculares são extremamente raras na verdade a Gente Nem considera a sua existência devido à
Baixa probabilidade de três moléculas se chocarem Então embora essa lei de velocidade ou melhor embora esse mecanismo esteja de acordo com essa lei de velocidade ele é pouco provável a lei de velocidade é essa mas é muito pouco provável essas três moléculas se chocarem ao mesmo tempo então nós devemos propor um outro mecanismo Qual é um outro mecanismo razoável para isso vamos imaginar então que a reação ocorre agora em três etapas e não apenas em duas onde eu tenho duas moléculas de no formando esse intermediário o n2 O2 essa reação está em equilíbrio por que
que está em equilíbrio porque a etapa posterior é a etapa lenta da reação o n2 O2 reage com H2 para formar o n2ox daqui é etapa lenta dá tempo suficiente do no entrar em equilíbrio com o n2ox isso a outra etapa é uma etapa rápida normal o n2ox com H2 formando n2 e h2oo tudo nós temos a reação Global a etapa lenda desta reação é a segunda etapa e nela nós temamos como lei de velocidade o k constante de velocidade da segunda reação que multiplica a concentração do n2 O2 e a concentração do H2 repare
que isso aqui é uma reação bimolecular e uma reação bimolecular é uma reação muito mais eh provável muito mais sensata do que uma reação term molecular Então esse é o mecanismo mais adequado do que o mecanismo proposto acima Mas e aí é claro que essa lei de velocidade a lei de velocidade do NO2 a Quad que eu multiplica H2 é diferente do segundo mecanismo proposto isso não é a mesma coisa disso mas essa lei de velocidade é esquisita não tem como ser essa reação ocorrer através de um mecanismo ter moole o que que a gente
vai fazer agora é meramente uma manipulação matemática eu tenho que escrever essa lei de velocidade de maneira que ela tenha uma cara igual a lei de velocidade Global Até porque aqui eu tô expressando a lei de velocidade em função do n2 A2 e o n2 O2 é um intermediário nós nunca devemos escrever a lei de velocidade Global em função do intermediário porque o intermediário eu não tenho domínio sobre ele eu não tenho como aumentar ou diminuir a concentração do intermediário para descobrir a sua ordem por exemplo o intermediário é formado ali no meio reacional E
logo depois ele desaparece Então eu tenho que escrever esta concentração do n22 em função do NO2 para aí a lei de velocidade da Etapa lenta ser igual a lei de velocidade da reação Global Como disse eu vou fazer um procedimento meramente matemático a partir desse mecanismo eu posso chegar algumas conclusões primeiro a lei de velocidade de formação do n22 que eu V tô chamando de velocidade direta é igual a constante desta reação direta que multiplica a concentração do no ao quadrado uma reação de ordem dois lembre-se que eu tô falando de uma reação elementar e
portanto o coeficiente estequiométrico tem que ser igual ao expoente por outro lado a lei de velocidade inversa né decomposição do un2 O2 para formar o no pode ser escrita como velocidade inversa igual constante dessa reação inversa que multiplica a concentração do n2 O2 e que informação eu tenho se essa reação está em equilíbrio nós Não vimos ainda o conceito de equilíbrio químico mas isso vocês carregam do ensino médio se essas duas reações estão em equilíbrio eu posso dizer que a velocidade direta é igual à velocidade inversa ISO significa que a concentração do un2 qu multiplicado
pelo KD é igual a Ki que multiplica a con cração do n2 O2 e da aí resolvido o problema essa expressão me permite correlacionar a primeira lei de velocidade a lei de velocidade Global com a lei de velocidade da Etapa lenta Como assim é simples é só escrever que a concentração do n2 O2 vai ser igual o KD que multiplica no qu dividido por Ki e pronto eu tenho uma expressão para o n22 em do no quadrado é só pegar essa expressão agora e jogar na lei de velocidade da Etapa lenta E aí eu tenho
que a lei de velocidade passa a ser então K2 a constante da segunda etapa que multiplica constante da reação direta divide pela constante da reação inversa multiplica a concentração do noo quadrado e multiplica a concentração do H2 Aqui nós temos uma lei de velocidade com a cara da lei de velocidade Global onde nós temos uma reação de ordem dois em relação ao no e Ordem 1 em relação ao H2 é óbvio que esse produto de constante né o K2 KD e Ki na verdade é o que eu chamo de k g né de constante global
ou de constante de velocidade da reação Global O que que tem que ficar claro desse mecanismo eu escrevi em função da Etapa lenta Eu só não expressei em função do intermediário ário eu expressei em função do reagente que está completamente coerente com a lei de velocidade Global Lembrando que a concentração do in2 O2 é a mesma coisa que a concentração do ni ao quadrado que multiplica KD e divide Ki Então esse é um exemplo de como o bom senso químico a intuição química é capaz de melhorar o mecanismo da reação se eu não tenho esse
bom senso eu aceito esse primeiro mecanismo como o válido e o ponto final porém ele não é o adequado o mais adequado é esse de baixo Pode ser que exista um outro mecanismo mais adequado Ele ainda não foi proposto mas se eu propor e consegir provar que esse mecanismo é mais adequado eu simplesmente posso publicar esse mecanismo ele vai fazer parte da literatura e vai contribuir para o entendimento melhor da química bom é isso eu espero que vocês tenham gostado do vídeo Se vocês gostaram então por favor dê o seu like Não deixe de compartilhar
principalmente se alguém tiver com algum problema na parte de mecanismo compartilhe esse vídeo indique pro seu professor pro seu colega pro seu aluno isso vai ajudar muito no crescimento da Universidade da química e se você for novo por aqui não se esqueça de se inscrever no canal tá ok bom então até a próxima da Universidade da química
Related Videos

15:01
Episódio 13 - Agilizando!#1 (Catálise Hete...
Universidade da Química
23,223 views

29:37
REAÇÕES ORGÂNICAS DE SUBSTITUIÇÃO
QUÍMICA DO MONSTRO
248,546 views
![14. Mecanismo de Reação SN1 e SN2 | Substituição Nucleofílica | Reação Orgânica [QO]](https://img.youtube.com/vi/W-RlgUfDwRc/mqdefault.jpg)
16:30
14. Mecanismo de Reação SN1 e SN2 | Substi...
Química com Prof. Paulo Valim
29,209 views

17:22
Episodio 4 - Colocando ordem nas coisas! (...
Universidade da Química
67,845 views

31:56
CINÉTICA QUÍMICA | AULA DE REVISÃO | AULA 10
Professor Igor Química
114,431 views

26:12
How to Remember Everything You Read
Justin Sung
2,380,450 views

13:24
Mecanismos de reação I
Química Orgânica Avante
17,696 views

44:08
MegaQuímica #1 Reações de Substituição Nuc...
Universidade da Química
261,548 views

46:53
MegaQuímica #6 Reações de Eliminação (E1/E...
Universidade da Química
133,421 views

31:54
CINÉTICA QUÍMICA - VELOCIDADE MÉDIA
QUÍMICA DO MONSTRO
237,215 views

28:57
INTRODUÇÃO ao EQUILÍBRIO QUÍMICO: Conceito...
Marcelão da Química
141,790 views

17:29
FATORES QUE ALTERAM A VELOCIDADE DAS REAÇÕES
Professor Gabriel Cabral
13,309 views

18:19
FUNÇÔES ORGÂNICAS: identifique sem medo!!!
Café com química - Prof Michel
1,034,043 views

14:45
Episódio 3 - Qual é sua velocidade agora? ...
Universidade da Química
38,012 views

34:09
Introdução as Reações Ácido-Base em Químic...
QUÍMICA PRIMORDIAL
3,214 views

44:24
REAÇÕES ORGÂNICAS - ADIÇÃO E ELIMINAÇÃO
QUÍMICA DO MONSTRO
273,584 views

Cozy Winter Coffee Shop Ambience ⛄ Jazz Re...
Relax Jazz Cafe

11:11
Introdução aos mecanismos de reação | Quím...
Khan Academy Brasil
36,518 views

13:01
🧪 LEI DA VELOCIDADE - RÁPIDO E FÁCIL
Professor Gabriel Cabral
116,430 views

39:48
REAÇÕES ORGÂNICAS I - MODERNA ABORDAGEM
Café com química - Prof Michel
50,333 views