Unknown
0 views28498 WordsCopy TextShare
Unknown
Video Transcript:
f p bom dia bom dia com a palavra o diretor Presidente substituto da Agência Nacional de Vigilância Sanitária Bom dia senhoras e senhores Bom dia a todos que nos acompanham aqui na sala de reuniões da Diretoria colegiada da Anvisa na sede da agência em Brasília Bom dia a todos os servidores que nos acompanham também pelo canal da anva no YouTube todos os demais cidadãos que nos acompanham pelo link da Anvisa no canal da Anvisa no YouTube link disponível no portal da agência eu cumprimento meus colegas diretores a diretora meu Freitas cumprimento diretor Daniel Pereira cumprimento
o nosso procurador chefe Fabrício Braga e a nossa secretária geral Liliam Pimentel também a nossa ouvidora D Samara Carneiro em 27 de novembro de 2024 às 9:50 verifiquei o có necessário portanto daremos início a 23ª reunião ordinária pública da diretoria colegiada do ano de 2024 eu consulto os diretores se tem itens a serem incluídos ou retirados de pauta passo presso a informação inicial de quem razão do afastamento oficial para fora do país do diretor presidente Dr Antônio barra Torres e na condição de diretor Presidente substituto nos termos do parágrafo terceiro do artigo 172 do regimento
interno da Visa eu procederei com a relatoria dos itens 2.1 o item 2.2 e o 6.11.1 eh ainda Solicito a inclusão em Pauta da proposta de alteração do calendário de reuniões públicas da Diretoria colegiada de 20224 peço a inversão de pauta desse item e do item 6.1.1 para que eles sejam deliberados no início dessa sessão Por fim eu retiro de pauta o item 2.11 passo a palavra à diretora meiruze Freitas Bom dia presidente cumprimento meu colega diretor Daniel cumprimento procurador chefe Fabrício a ouvidora a secretária dacol lía Pimentel cumprimento a todos que acompanham essa sessão
ordinária pública que acompanha também de forma online desejando a todos uma boa reunião da diretoria colegiada e de muito fruto eu inicialmente reforço que eu não tenho nenhum item a incluir ou a retirar de pauta Obrigado diretora meiru passo a palavra ao diretor Daniel Pereira Bom dia cumprimento nosso presente substituto diretor rson Mota minha colega diretora meru Freitas nosso procurador para os itens 2.6 2.7 2.8 2.9 e 3.41.1 que serão realizados no momento das deliberações das matérias passo Então à pauta apreciaremos neste momento o item incluído pelo diretor Presidente substituto Dr rson Mota nesta reunião
trata-se da proposta de alteração do calendário de reuniões públicas da Diretoria colegiada da Anvisa do ano de 2024 relatoria o diretor Presidente substituto Dr rson Mota que está com a palavra Obrigado D diretores em função do do elevado número ainda de matérias que precisamos deliberar esse ano a proposta de alteração do calendário de reuniões públicas da Diretoria coleg da Anvisa deste ano de 2024 para que possamos incluir mais uma reunião ordinária pública no próximo dia 19 de dezembro Essa é a proposta que eu coloco em discussão e votação com o diretor Daniel Pereira De acordo
Presidente Obrigado diretor Daniel diretora meu Freitas de acordo Ok obrigado portanto fica aprovado por unanimidade este item da pauta agora trataremos o item que trata do assunto deliberativo de governança e gestão referente ao item 6.1.11 que foi invertido na pauta é a proposta do calendário de reuniões da diretoria colegiada Dan Anvisa para o ano de 2025 relator diretor presidente Dr rson Mota que está com a palavra obrigado OB Dra Lília eu consulto os diretores se estão de acordo com a proposta do calendário de reuniões públicas da diretoria colegiada para o ano de 2025 que foi
previamente disponibilizada pela Secretaria Geral da diretoria colegiada aos senhores coloco em votação diretor Daniel Pereira De acordo Presidente Obrigado diretor Daniel diretora meiruze também de acordo Obrigado diretora meiros portanto fica aprovado por unanimidade o item 6.1.1 P1 da pauta vamos tratar agora o item 2.1 propostas de atualização da agenda regulatória 2024/2025 e de arquivamento de processos regulatórios relator diretor presidente subistituto Dr rson Mota a quem eu passo a palavra Obrigado Lila é o voto 519 de 2024 do gabinete do diretor presidente do relatório e análise a área responsável e asre do gadip a agenda regulatória
é um instrumento de planejamento da atividade normativa que contém o conjunto dos assuntos prioritários a serem regulamentados pela Anvisa durante a sua vigência o principal objetivo da agenda regulatória é aprimorar o marco regulatório em vigilância sanitária promovendo a transparência e a previsibilidade tanto para os setores envolvidos quanto para os cidadãos a inserção de um projeto regulatório na agenda regulatória é a primeira etapa do processo regulat os projetos incluídos compreendem assuntos sujeitos à atuação da Anvisa e estão relacionados a processos de trabalho exigências ou requisitos referente a produtos serviços e estabelecimentos regulados pela agência durante o
processo de regulamentação é incentivada a participação colaborativa de toda a população para isso é importante acompanhar o desenvolvimento dos dos projetos regulatórios da agenda já a atualização da agenda regulatória tem por objetivo manter a agenda aderente às prioridades de atuação regulatória alinhar os temas ao dinamismo do cenário regulatório sanitário e aumentar a confiança na previsibilidade da agência como resultado da atualização da agenda regulatória foram excluídos nove temas incluídos oito temas e alterado um tema ficando a agenda 2024/2025 com 171 temas e sendo esta a primeira vez em que na atualização da agenda o número de
exclusões de tema foi maior que o número de inclusões a lista atualizada de temas da agenda regulatória que indica os temas alterados concluídos incluídos ou excluídos em novembro de 2024 encontra-se acostada ao documento número 329 2740 do respectivo processo com exceção de dois temas que já haviam sido iniciados e estavam sendo tratados fora da agenda o tema 3.35 6.36 que referem-se respectivamente à regulamentação da extrapolação de limites máximos de resíduos de insumos farmacêuticos ativos entre espécies animais e a revisão da lista positiva de monômeros outras substâncias iniciadoras e polímeros autorizados para uso em materiais plásticos
da gerência Geral de alimentos os outros seis temas indicados para inclusão são novos assuntos entre os novos temas dois foram sinalizados pelas como relacionados ao Complexo econômico industrial da Saúde os seis sendo os temas 8.46 e 11.2 respectivamente a atualização da pesquisa clínica de produtos de terapia avançada em função da publicação da Lei 14 874 de 2024 que seria uma que será uma atualização da RDC 506 de2021 e a disponibilização da base de dados sobre identificação única de dispositivos médicos da visa na forma do que determina o parágrafo terceiro do artigo 15 da RDC 591
de 2021 em relação aos nove temas excluídos quatro não estavam iniciados um tema estava replicado na lista da agenda dois tratam de assuntos internos e dois estavam em análise de impacto regulatório nos termos da minuta do documento número 329 2455 a atualização da agenda regulatória é essencial para garantir que as ações regulatórias da Anvisa sejam dinâmicas eficientes e alinhadas às necessidades de saúde pública e ao contexto Global isso fortalece o ambiente regulatório assegura que novos desafios sejam rapidamente enfrentado enfrentados e melhora a confiança de todos os envolvidos no sistema de saúde portanto do voto Eu
voto pela aprovação da proposta de atualização da agenda regulatória 2024/2025 e pelo arquivamento de processos regulatório nos termos deste voto é o que submeto a apreciação desta diretoria colegiada coloco em discussão em votação e passo a palavra ao diretor Daniel Pereira Obrigado Presidente recentemente tivemos a nossa reunião de alinhamento estratégico onde debatemos os resultados da Estratégia da agência quero destacar que todo o trabalho feito pela plan e pelas reg na elaboração dessa proposta em conjunto com todas as diretorias onde a gente de fato sinaliza para todo o setor eh Quais são os o Os projetos
estratégicos que iremos tratar né as agendas estratégicas que iremos tratar no nome dessa diretoria colegiada conferindo cada vez mais previsibilidade conferindo cada vez mais segurança jurídica e permitindo que a própria sociedade nos retorne com as demandas que entendo necessários que sejam tratadas por essa diretoria colegiada E como sempre essa diretoria ouve a sociedade e esse a proposta que hoje colocada em votação reflete o final desse trabalho eu parabenizo todos des envolvidos parabenizo o relator Por trazer o item sigo na íntegra Obrigado diretor Daniel Pereira com a palavra diretora meru Freitas ressalta a importância da previsibilidade
da agenda regulatória eh que Pese a gente também entender que no âmbito da do do trabalho contínuo aparece novos temas que precisam ser discutidos de forma eh prioritária às vezes dependendo do da Necessidade chama atenção especialmente que a gente tá num ambiente cada vez mais discussões de inovações né então acho que talvez nos próximos anos os diretores vão trabalhar cada vez mais com sandbox regulatório então é um outro ponto também que Para para pensar quando eu olho 172 temas é muito tema né mas que mostra Nossa complexidade chama atenção que dentro do dos temas Próximo
ano talvez a gente precise a a Anvisa discutir xeno transplante que hoje já vem discussões de Pesquisas não tem uma regulamentação muito clara nenhum em nenhuma autoridade é uma terapia avançada mas que a gente Verifica que talvez seja um bom exemplo para se trabalhe também com sandbox regulatório então tô colocando esse ponto aqui só para destacar pros senhores dois diretores que estarão aqui eh no próximo ano que talvez esse seja um tema que venha também a bancada e precisa de uma atenção especial e pode ser que o melhor modelo de trabalhar com essa inovação seja
realmente um sandbox regulatório dito isso eu agradeço e voto integralmente Obrigado diretora meirus de fato a nossa assessoria de melhoria da da qualidade regulatória danv a tá trabalhando né nesse processo S de box regulatórias e a gente tem expectativa aqui no os próximos meses já submeta ao colegiado esse normativo eu declaro portanto aprovado por unanimidade o item 2.1 da pauta item 2.2 proposta de resolução da diretor ada para dispor sobre procedimento de liberação de lotes de vacinas e soros hiperimunes heterólogos para consumo no Brasil e para exportação relator diretor Presidente substituto Dr rson Mota quem
passo a palavra Obrigado D Lilian é o voto 512 de 2024 do gabinete do diretor Presidente área responsável é aeg é um tema da agenda regulatória é aqueles temas de revisão e consolidação de normas do estoque regulatório da Anvisa portanto não é não traz nenhuma mudança de mérito apenas uma consolidação a proposta em questão refere-se à revisão normativa da resolução da diretoria colegiada 73 de 2008 a qual dispõe sobre procedimentos de liberação de lotes de vacina e sores e soros hiperimunes heterólogos para consumo no Brasil e para exportação tal revisão Foi iniciada quando ainda era
vigente o decreto 10139 de 2000 que seu que em seu artigo 19 inciso 2 determinava os integrantes da administração pública federal direta e indireta a revisão e consolidação de Atos normativos inferiores a decretos no início do primeiro ano de cada mandato presidencial com término até o segundo ano do mandato presidencial o decreto 1039 foi revogado pelo decreto 12002 de 2024 vigente a partir de do 1eo de junho de 2024 que Manteve a obrigatoriedade de medidas periódicas de revisão e consolidação normativa na forma estabelecida em plano de trabalho de cada órgão ou entidade no âmbito da
Anvisa os procedimentos a serem seguidos na condução dos trabalhos de revisão e consolidação de normas estão fixados na portaria 863 de 2023 assim a vista dos parâmetros consignados no decreto 10139 de29 e posteriormente no decreto 12002 de 2024 bem como na portaria 863 de 2023 efetuou-se a revisão normativa da RDC 73 de 2008 o processo de revisão foi conduzido pela assessoria de melhoria da qualidade regulatória aseg no decorrer do processo o Instituto Nacional de Controle de Qualidade em saúde o incqs foi consultado sendo um dos principais interessados externos no no eh no tema da RDC
73 de 2008 também foram realizadas consultas às áreas da Anvisa interessadas no tema a gelas a ggb a GG fis a GG paf e ao final definiu-se pela revisão de forma da resolução sem alteração no seu mérito conforme documentado no despacho 220 2024 sepror asre Anvisa A procuradoria federal junto a Anvisa se manifestou no parecer 175 de22 4 pelo prosseguimento da Marcha processual da proposta regulatória após a manifestação da procuradoria uma nova minuta da RDC documento C 328 2422 foi elaborada pel as reg constitui o texto final resultante do processo de revisão normativa do voto
tendo em vista o exposto voto pela aprovação da proposta de resolução da diretoria colegiada 73 de28 documento se 328 2422 que dispõe sobre o regulamento técnico para procedimento de liberação de lote de vacina e soros hiper imunos heterólogos para consumo no Brasil e também para exportação é o tema que coloco em discussão e votação com o diretor Daniel Pereira Obrigado presidente parabenizo Por trazer o item à pauta é um item sempre muito importante da gente estar deliberando aqui sobre dando as condições ideais para que a gente tem cada vez mais um cenário vacinal no Brasil
e eu sigo na íntegra proposta da relatoria Obrigado diretor Daniel com a palavra diretora meuso Freitas Obrigada Presidente eu sigo a relatoria Obrigado diretora meuso portanto declara aprovado por unanimidade o item 2.2 da pauta próximo item 2.3 proposta de instrução normativa para atualizar a lista as listas de constituintes de limites de uso de alegações e de rotulagem complementar dos suplementos alimentares relatora diretora dout meiruze Freitas que está com a palavra obrigada lía é o voto 255 de 2024 inicio o tema fazendo um breve recorte que Aisa comemorou no dia 18 de novembro de de novembro
de 24 os 25 anos da regulação para a promoção da alimenta a segura e saudável reunindo representantes dos conselhos profissionais empresa e sociedade este Marco celebra as conquistas e avanços na regulação de alimentos no Brasil que ao longo desses anos aprimoraram e modernizaram as normas de segurança alimentar as regulamentações adotadas pela Anvisa ajudaram a posicionar o Brasil entre os países com os mais elevados padrões de controle sanitário reforçando o compromisso com a segurança alimentar e a qualidade da produção Nacional aquela celebração também destacou a importância da colaboração entre diferentes setores para alcançar esses resultados refletindo
o esforço contínuo para garantir a proteção da saúde e a qualidade dos alimentos consumidos durante o evento foi destacado que mais de 60% da produção da Agricultura Familiar no Brasil é destinada à indústria alimentícia ressaltando a importância dessa produção no abastecimento do setor alimentício Nacional Outro ponto relevante abordado foi o apoio e estímulo à alimentação saudável que está alinhada aos objetivos globais de reduzir a fome e combater as vulnerabilidades associadas em segurança alimentar essas iniciativas mostram como Aisa integra sua missão de saúde pública com ações que impactam positivamente a segurança alimentar o acesso a alimentos
saudáveis e a promoção de práticas alimentares sustentáveis é Neste contexto que trago aqui mais uma proposta de Norma da área de alimentos trata--se de uma apreciação de minuta de instrução normativa para atualização de instrução normativa 28 de 2018 que estabelece a lista de constituintes de limites de uso de alegações de rotulagem complement dos suplementos alimentares a nota técnica 107 da gerência Geral de alimentos traz fundamentação da referida intervenção a fim de mostrar sua adequação ao termo de abertura do processo Tap 37 de julho de 2024 a atualização periódica da lista de constituintes de limites de
uso de alegações de rotulagem complementar dos suplementos alimentares decorre da manifestação técnica favorável da G a petições protocoladas pelas empresas interessadas demandas fundamentadas apresentadas pelos agentes afetados ou inconsistência pontuais identificadas nas alterações fornecidas por meio das atividades rotineiras de gestão do estoque regulatório conduzido pela Unidade de acordo com Tap 37 de 2024 essas atualizações seguem o fluxo de dispensa de análise de impacto regulatório e dispensa de consulta pública por se caracterizar como de baixo impacto no caso as alterações propostas na instrução normativa 28/28 estão relacionadas às alterações dos seguintes constituintes para o uso em suplementos
alimentares proteína hidrolizada de carne bovina óleo de semente bluco avenes extrato seco de jabuticaba extrato de gramb em pó Associação de lactobacilos acidofilos la14 lactobacilos ranus e lactoferrina bovina e Associação de lactobacilos ramus e lim limil lactobacilos reuteri ainda está sendo proposta a alteração para que o nome da substância bioativa antio sinin seja complementados pela fonte de constituinte utilizado em função da aprovação do novo constituinte extrato seco de jabuticaba e duas adequações de nota de rodapé anexo 1 da in 28 de 2018 para esclarecer o público alvo dos Suplementos líquidos de eletrólitos não são vislumbrados
aumento expressivo de custos para os agentes econômicos afetados com Tais correções e para evitar impactos eventuais nos suplementos alimentares que já se encontram no mercado a minuta normativa propõe o prazo de 24 meses para adequação das rotulagens dos suplementos alimentares que temam sido que temem sua composição alguns dos constituintes previstos na referida minuta e que tenham sido regularizados junto ao Sistema Nacional de Vigilância Sanitária até a data da publicação da instrução normativa essas mudanças são baseadas em uma avaliação de risco pré-mercado que tem como objetivo garantir a segurança do consumo humano além de oferecer novas
alternativas tecnológicas aos fabricantes de alimentos todos os documentos que embasam essas alterações são de acesso público in ind os pareceres da área técnica exceto quando há restrições legais por último destaco que a proposta normativa foi elaborada Com base no modelo pré-definido e validado pela procuradoria federal junto a Anvisa e seguiu as diretrizes das boas práticas regulatórias desta Anvisa conforme estabelecido na portaria 162/2021 Diante do exposto voto favoravelmente a proposta de instrução normativa para atualização periódica da lista de constituinte de limites de uso de alegações e de rotulagem complementar dos suplementos alimentares publicada por meio da
in 28 de 26 de julho de 2018 mais uma vez destaca o brilhante trabalho da ggal E é este o voto que submeta a apreciação e a deliberação dessa diretoria colegiada e obrigada obrigado diretora me Freitas coloco ter discussão e votação passo a palavra ao diretor Daniel Pereira Obrigado Presidente sigo na íra a proposta da relatoria Obrigado diretor Daniel também parabenizo a ggal pelo excelente trabalho talvez a diretora tência das Áreas que mais teve atualização de regulamento nos últimos nos últimos anos eh também acompanha o seu voto fica portanto aprovado por unanimidade o item 2.3
da pauta item 2.4 proposta de instrução normativa para atualizar a instrução normativa número 258 de 16 de outubro de 2023 que define a lista de impurezas qualificadas e seus respectivos limites para inclusão de novas impurezas relatora diretora D meiruze Freitas a quem passo a palavra obrigada lía é o voto 254 de 2024 também reforço a importância desse tipo de medida Especialmente na transparência previsibilidade na simplificação dos processos especialmente no registro de medicamentos sintéticos e semissintéticos a referida instrução normativa estabelece entre outros parâmetros que as impurezas ou produtos de degradação acima dos limites de qualificação devem
ter o perfil de segurança avaliado ou seja devem ser qualificados quanto à segurança os critérios para as qualificações desses compostos Estão dispostos no artigo 10 da resolução da diretoria colegiada 53 de 4 de dezembro de 2015 e são conforme disposto na Norma quando o composto forom metabólico quando estiver descrito na literatura científica ou compêndio oficiais e quando foram avaliados os estudos de toxicidade e por fim quando a exposição for igual ou inferior ao expresso na lista publicada em instrução normativa específicas e suas atualizações chama atenção que nós incluímos a previsão da lista na RDC 821
de 16 de outubro de 23 a qualificação desses compostos ocorre por meio de uma avaliação de segurança consolidada em pareceres emitidos pela área técnica especialmente pela gerência de eficácia e segurança da ggm desde 2018 apenas foram considerados para publicação aqueles compostos que foram qualificados a partir de dados públicos com artigos publicados em periódicos indexado destaca--se o caráter restrito desses pareceres uma vez que contém informações confidenciais dos detentores de registro por exemplo as especificações do produto Neste contexto não deve ser dado publicidade os pareceres na íntegra a atualização periódica da lista de impurezas qualificadas e seus
respectivos limites Segue o fluxo regulatório de dispensa de análise de impacto regulatório e de consulta pública por baixo Impacto ou seja redução de curos regulatórios se mostra a redução dos curos regulatórios se mostra Clara quando dá não necessidade por parte do solicitante de conduzir novas avaliações ou novos estudos para a qualificação de uma impureza constante na lista a gcf emitiu a nota técnica 31 de 2024 que consolidou as evidências baseadas em dados públicos que subsidiam a publicação da atualização do anexo da in 258 de 23 apresentando os critérios técnicos adotados para cada sugestão de exclusão
alteração e inclusão de impureza na referida lista a referida nota técnica foi uma recomendação do parecer 19 das asre gadip a acerca da adequação da instrução processual da proposta de abertura do processo regulatório nos termos da portaria 162/2021 a procuradoria federal junto a ava se manifestou por meio do parecer 172 2023 no início do processo regulatório onde concluiu que a proposta analisada em contra suporte jurídico e opinou favoravelmente ao prosseguimento da Marcha processual regulatória para o efeito desse voto tem-se que o processo eletrônico encontra-se a adequadamente instruído contendo minuta de instrução normativa nota técnica da
gsef e cópia dos pareceres técnicos de qualificação de impurezas e produtos de degradação de medicamentos sintéticos lembro que a resolução da diretoria colegiada 53 de 2015 é um Marco importante paraa regulação de medicamentos no Brasil ela estabelece diretrizes para notificação identificação e qualificação de produtos de degradação em medicamentos com o objetivo de assegurar que a qualidade e a segurança dos medicamentos sejam mantidas durante o seu ciclo de vida desde a fabricação até o consumo isso é especialmente relevante para substâncias ativas sintéticas e semissintéticas além de medicamentos classificados como novos genéricos e similares esses parâmetros são
essenciais para proteção da saúde dos pacientes pois a degradação dos medicamentos pode afetar a sua eficácia segurança além de representar risco à saúde a RDC 53 exige que as empresas responsáveis pelos medicamentos monitorem e informe quaisquer sinais de degradação garantindo que as medidas corretivas corretivas sejam tomadas rapidamente quando necessários a qualificação de impureza em medicamentos é um processo crítico e envolve avaliação detalhada das impurezas presentes nas substâncias ativas ou ecip e sua relação com os limites de segurança estabelecidos para o medicamento a qualificação de impureza é realizado por meio de um ajustamento específico protocolado pela
gerência eh Especialmente na gerência geral desculpa na gerência de eficácia e segurança esse esse adamento pode ser classificado como a petição secundária ou terciária dependendo da vinculação a uma petição de registro de medicamento ou uma alteração pós-registro após o protocolo a CF realiza uma análise detalhada da documentação apresentada e emite um parecer consultivo sobre os critérios de impureza é comum no processo regulatório de medicamento que as impurezas ou produtos de degradação já avaliados em registros anteriores sejam repetidos em novos protocolos Especialmente quando há o registro de um novo produto com o mesmo insumo farmaceutico ativo
ou desenvolvimento de novas formas farmacêuticas para um IFA já conhecido como as informações sobre essas impurezas já foram avaliadas anteriormente e muitas vezes são muito similares à já apresentadas em outros registros o processo de qualificação pode se tornar redundante por isso essas novas petições podem ser ser subsidiadas por informações semelhantes às que foram previamente analisad com dados toxicológicos e especificações previamente estabelecidos para as impurezas esse procedimento garante que mesmo com a repetição de alguns dados A análise seja adaptada ao novo contexto e ao novo produto mantendo a consistência da atualização das informações de segurança Além
disso é uma maneira de assegurar que o medicamento atenda aos requisitos regulatórios para o controle de qualidade mesmo quando as características do IFA ou das impurezas permanecem inalterada porém a Anvisa vem buscando a redução de exigências e simplificação do processo uma vez que há um histório técnico com avaliação dessas impurezas isso pode ser feito por meio de referência ao histórico anterior de qualificação visando evitar uma repetição desnecessária do processo e agilizar A análise regulatória uma vez determinado o limite para a impureza por meio de dados Públicos como que ocorre para os compostos ser incluídos na
lista a submissão e análise de petições para qualificar esses limites torna-se um trabalho de repetição tanto para o setor regulado quanto para a agência esse retrabalho Visa ser sanado pela Public dessa lista uma vez que novos limites de publicação não carecer de submissão de de novo protocolo e nova avaliação a criação de uma lista pública com limites pré-definidos para impureza representa um avanço significativo no processo regulatório quando os limites de impureza são determinados com base nesses dados já avaliados e em anális anteriores torna-se evidente que a repetição de submissões para qualificação desses mesmos é um
esforço desnecessário a publicação dessa lista objetiva padronizar e consolidar os limites de impureza já avaliados e considerados Seguros eliminando a necessidade de submissão de novos protocolos para impurezas previamente qualificada essa medida também está aliada com as melhores práticas regulatórias que incentiva a otimização do processo eliminando etapas redundantes sempre que possível sem comprometer a qualidade e a segurança dos medicamentos a adoção de limites pré-definidos agiliza a tramitação de petições relacionadas a Registro e pus registro de medicamento uma vez que parte da análise técnica já está consolidada a proposição também está alinhada com objetivo estratégico da Anvisa
de melhorar a eficiência regulatória sem comprometer a segurança e qualidade dos medicamentos a proposta de atualização de lista de impurezas qualificadas apresentam ampliação e refinamento significativo são duas exclusões oito alterações nas impurezas anteriormente listadas além da inclusão de 12 impurezas novas referente a 11 insumos farmacêuticos ativos a versão atualizada da lista agora inclui 29 compostos qualificado um aumento de mais de 50% em relação à versão atualmente vigente regulamentada pela instrução normativa 258 de 23 esse incremento reflete nosso compromisso com ampliação E modernização do controle de qualidade a proposta traz uma revisão e aponta para a
exclusão da impureza C do brometo de rocurônio e anel aberto de fos de fosfomicina trometamol da lista de impureza qualificadas o que reflete a necessidade de alinhamento com critérios técnicos definidos pela in 258 de23 particularmente No que diz respeito à disponibilidade de dados quantitativos confiáveis para avaliação dessa substância A decisão se baseia na insuficiência de dados quantitativos que possibilitem a determinação da exposição a cada metabólito em Matriz biológica humana ou animal de forma confiável o que fundamenta a reavaliação conforme enquadramento das impurezas nos termos estabelecidos no artigo 1 da in 258 de 23 que trata
da qualificação dos limites importante pontuar que a exclusão não decorre de novas evidências ou preocupações relacionadas à segurança toxicológica das impurezas dos limites anteriormente estabelecidos portanto os limites qualificados previamente à publicação não representam riscos da saúde e a decisão é motivada exclusivamente por aspectos técnicos e metodológicos a gcf considera que não será necessária a adequação dos produtos já registrados com base nos limites anteriormente publicados uma vez que a exclusão não se fundamenta em uma revisão de segurança a exclusão é uma medida preventiva sem Impacto sobre a segurança ou a eficácia dos produtos que segue os
limites previamente qualificados embora as exclusões possam parecer um retrocesso elas elas reforçam a transparência e a integridade do processo regulatório garantindo que a lista de impureza qualificada reflita Os mais altos padrões de confiabilidade técnica e científica a proposta de alteração n impurezas qualificadas é essencial para modernização da regulamentação e demonstra um compromisso com a ciência a segurança do setor farmacêutico tem uma número de fármacos eu para adiantar o voto não vou ler também tanto da parte de inclusões aqui eu queria dizer que da parte especialmente eh da parte de de de alteração são oito e
da parte de inclusão também para adiantar o voto são 11 em Pureza o processo regulatório relatado está em conformidade com as diretrizes para a melhoria da qualidade regulatória aliando-se aos princípios aos princípios da eficiência transparência e fundamentação científica queria lembrar que o meu voto é público Então vai estar disponibilizado com todas as substâncias e o detalhamento além de observar rigorosamente o suporte da procuradoria necessário para sua continuidade sua implementação trará benefícios direto à saúde pública e ao setor regulado além de promover mais efici qualidade nas decisões regulatórias é uma atualização robusta que reforça o compromisso
da Anvisa em promover um ambiente regulatório eficiente e cientificamente fundamentado a ampliação da lista reduz barreiras regulatórias e facilita a introdução de novos medicamentos beneficiando diretamente os pacientes Não poderia finalizar esse voto sem ressaltar o valoroso trabalho do Rafael chances da ggm que em conjunto com a g CF e sobre a provocação da segunda diretoria desempenhou um papel fundamental na regulamentação e na otimização das análises relacionadas à impureza essa iniciativa culminou na elaboração da instrução normativa já citada um marco regulatório que a que aprimora significativamente a gestão das impurezas em medicamentos É com grande satisfação
que trago a atualização dessa lista de impurezas qualificadas evidenciando que a equipe está empenhada em concluir avaliações para futuras revisões e em próximo bem próximo inclusive além disso destaco a visão inovadora e estratégica do Rafael Sanches com a implementação de um projeto Pioneiro para o uso de inteligência artificial na análise de impureza esse projeto consolida o protagonismo da Anvisa na busca por melhorias constantes e na adoção de novas tecnologias permitindo análise mais ágeis E fundamentada essas essa abordagem inovadora rea afirma o compromisso da Anvisa com a excelência regulatória mostrando que estamos no caminho certo para
consolidar um ambiente regulatório cada vez mais ágil seguro e eficaz assim a partir do exposto voto favoravelmente a alteração da instrução normativa 258 de 2023 para atualização periódica da lista de impurezas qualificadas e seus respectivos limites na forma do anexo 1 da in em atendimento aos critérios de qualificação de impureza descritos na RDC 53 de 4 de dezembro de 2015 e suas atualizações é este o voto que submeto a apreciação e a deliberação dessa diretoria colegiada muito obrigada obrigado diretora meu coloco o tema em discussão e votação diretor Daniel Pereira com a palavra Obrigado Presidente
cumprimento a diretora meru pela qualidade do seu voto e trazendo a importância do monitoramento de impureza no registro de medicamento e sigo na inteira V da relatoria Obrigado diretor Daniel também cumprimento a GG média agcf e acompanha o voto da diretora meirus fica portanto aprovado por unanimidade o item 2.4 da pauta item 2.5 relatório de análise de impacto regulatório e proposta de consulta pública para revisar a resolução da diretoria colegiada número 1204 de 27 de Dezembro de 2017 que dispõe sobre o enquadramento na categoria prioritária de petições de registro pós-registro e anuência prévia em pesquisa
clínica de medicamentos relatora diretora D meiruze que está com a palavra obrigada lía queria dizer também que esse Foi um tema que muitas vezes nós discutimos enquanto enquanto diretores aqui eh nas inovações que nos chegavam na nas questões que por vezes aparecia e temas levado à procuradoria Na necessidade do aprimoramento do marco regulatório para priorização de análise uma determinação inclusive da diretoria colegiada eh nas discussões eu queria lembrar que foram apontados melhorias no processo tanto da RDC 204 que que trata dos dos critérios de priorização de análise de medicamento especialmente registro e e pós-registro e
também chegou nessas discussões a questão relacionada à RDC 205 que é especificamente para para doenças raras contudo essa análise desse Impacto regulatório ela não abrange a 205 esse tema vai continuar em discussão e tá na agenda regulatória para os próximos anos agora circunda especialmente as discussões no âmbito da 204 e não da 205 fazendo esse esse aporte inclusive do do ponto de vista de pequenos ajustes até no próprio Air que tá na no processo e que já circundado até mesmo com colaborações para que seja ajustado claramente que se trata da 204 e não da 205
então é o voto 256 o assunto tratado está previsto na na atual agenda regulatória da Anvisa especificamente no projeto 8.35 da revisão dos critérios para fins de enquadramento na categoria prioritária das petições de registro pós registro e anuência prévia em pesquisa clínica de medicamentos conforme a relevância pública a revisão da 204 de 2017 e a 205 no entanto a 205 não será tratada neste momento o relatório de air está em Aprecia que está em apreciação foi elaborado com finalid subsidiar o processo de revisão da resolução da diretoria colegiada 204 de 2017 que dispõe sobre enquadramento
da categoria prioritária de registro e pós-registro e anuência prévia em pesquisa clínica de medicamentos segundo Anvisa A análise do impacto regulatório é um processo essencial para garantir a eficácia e a racionalidade das ações regulatórias esse procedimento consiste em uma avaliação prévia que Visa identificar e analisar o IMP os impactos potenciais das normas antes da sua implementação a ir permite que a VISA tome decisões mais informadas e baseadas em evidência avaliando a necessidade e adequação das intervenções regulatórias Além disso ela auxilia na verificação da Razão da intervenção regulatória garantindo que as ações da agência sejam proporcionais
necessárias e não excessivas conforme o princípio da eficiência administrativa ES que essa segunda diretoria avaliou a coerência e a conformidade do relatório de oir conforme descrito no artigo 22 da portaria 16 de21 elaborado pela equipe da dgm no relatório da ir conforme estabelecido pela referida portaria foi sumarizado o problem objetivamente o problema regulatório caracterizado pela priorização de uma grande quantidade de petições em relação ao total de petições protocoladas não necessariamente aumentado não não necessariamente aumentando o acesso da população a medicamentos importantes para a saúde pública os objetivos que seriam uma priorização exclusiva de petições de
alta relevância para a saúde pública as alternativas regulatórias possíveis e sugeridas e os seus impactos nessa avaliação regulatória foi identificado que os principais agentes afetados direta ou indiretamente pelo processo regulatório inclui pacientes e usuários de medicamentos que são diretamente impactados pela disponibilidade ou indisponibilidade de medicamentos priorizados o que pode afetar o acesso a tratamentos essenciais e a proteção da Saúde indústrias farmacêuticos que são influenciadas pela gestão do sistema de priorização tanto na competitividade para garantir a prioridade de seus produtos quanto na previsibilidade da análise de suas petições o Sistema Único de Saúde afetado pela celeridade
na aprovação e disponibilização de medicamentos estratégicos para atendimento das necessidades da população e pelo impacto no controle do custo do sistema público a Anvisa que enfrenta desafios no equilíbrio entre a celeridade das análises priorizadas e a previsibilidade das análises de petições Ordinárias gerando impacto no cumprimento de prazos e na alocação dos seus recursos da fundamentação legal rememoro que a Constituição Federal de 1998 1988 lá vou eu alterando a Constituição em sua atual redação oferece Diretriz fundamentais para o desenvolvimento científico tecnológico e da Inovação no Brasil refletindo o compromisso do estado com avanço da ciência com
o desenvolvimento econômico e social do país a partir da emenda 85 de 2015 importantes mudanças e inclusões foram feitas no texto constitucional evidenciando o papel central da Inovação e da pesquisa na agenda Nacional essas diretrizes expressa a visão estratégica do país para inovação e desenvolvimento tecnológico aliando aos desafios sociais econômicos e da Saúde ao reconhecer a importância da pesquisa da Inovação no desenvolvimento da economia Nacional a constituição reforça que a integração do conhecimento a capacitação científica e o aprimoramento tecnológico são fundamentais para o progresso do país a lei 6360 de 76 que regula o controle
sanitário do Comércio de medicamentos no Brasil foi alterada pela lei 13411 de 17 estabelecendo novas diretrizes para priorização de análise do pedido de registro de medicamentos e mudança pós-registro essa alteração tem um impacto direto na forma como a agência como avisa organiza e processa os pedidos com objetivo de melhorar a celeridade na análise de medicamento levando em conta sua importância para a saúde pública e inovação a lei 13411 de 2017 determinou que a VISA classificasse os pedidos de registro de medicamentos e as modificações para os registros em duas categorias petições de procedência ordinária petições que
são analisadas de forma regular seguindo o fluxo padrão de análise comoa dando Visa dando a devida atenção à sua complexidade técnica e as demais aspectos relevantes petições de de precedência prioritária neste caso A análise dos pedidos priorizados com base nos seguintes critérios complexidade técnica deve considerar a natureza do medicamento se ele envolve inovação científica ou tecnológicas ou se apresenta novas abordagens para o tratamento de doença benefício Clínico a eficácia e segurança do medicamento especialmente em relação a tratamentos de condições graves ou negligenciadas é um fator essencial para sua priorização benefício econômico relevância econômica do medicamento
no que tand de o custo da saúde pública acessibilidade impacto no sistema de saúde benefício social o impacto do medicamento na melhoria da Saúde da população particularmente para tratamento de doença com grande carga epidemiológica como doenças negligenciadas ou emergentes o decreto 877 de 2013 que regulamenta a lei 6360 estabelece a prioridade de análise para o registro de medicamentos que apresentam inovações radicais ou incrementais com a condição de que o medicamento seja fabricado no Brasil além disso O decreto prevê que a prioridade de análise seja concedida quando o núcleo tecnológico do produto também for fabricado no
Brasil importante mencionar a o que tem sido refletido e publicado nos decretos 11464 de 3 de abril de 2023 11482 de 6 de Abril de 23 Neste contexto a agência publicou a portaria de inovação Nacional de Vigilância Sanitária por meio da portaria 10000 de 28 de setembro de 23 essa portaria é um Marco importante para o fortalecimento da capacidade regulatória da agência especialmente no contexto de um amb de um ambiente de inovação crescente no Brasil alinhando-se com as políticas públicas nacionais e internacionais promovendo a inovação tecnológica e a indústria local e garantindo a segurança sanitária
no processo assim embora RDC 24 de 2017 tenha representado um avanço significativo no processo de priorização de registro e mudança pós-registro de medicamentos ainda existem lacunas e aprimoramentos relevantes que precisam ser abordados conforme o air e o cenário pós-pandemia covid-19 uma vez que a saúde pública é o principal objetivo da regulação sanitária e as políticas regulatórias devem estar alinhadas com bem-estar coletivo com foco na segurança sanitária acesso a medicamentos de qualidade e redução das desigualdades no acesso à saúde o cenário internacional a aplicação das experiências do cenário internacional oferece subsídios valiosos para a revisão do
processo normativo atual contribuindo diretamente para o fortalecimento da avaliação do impacto regulatório essa abordagem permite que a VISA incorpore práticas regulatórias bem-sucedidas adaptadas à realidade nacional com vista a aprimorar a eficiência e eficácia das nossas ações assim a integração dessas lições fortalece a ir ao oferecer um referencial prático e eficaz que alinha celeridade regulatória promoção da saúde pública e a inovação industrial permitindo que a VISA alcança o sistema de priorização mais justo ágil e alinhado às necessidades do Brasil no levantamento das experiências internacionais foram observadas diversas estratégias regulatórias adotadas por quatro regiões de interesses Estados
Unidos União Europeia Austrália e África do Sul essas regiões foram selecionadas por suas características distintas Estados Unidos e União Europeia representa agência de alta capacidade operacional com grande volume de demandas e uma robusta estrutura regulatória frequentemente utilizadas como referência Global Austrália e África do Sul representam agências com capacidade operacional mais semelhante a da Anvisa permitindo uma análise comparativa mais direta e adaptável à realidade brasileira é importante ressaltar que os programas de designações especiais de medicamentos implementados em outros países frequentemente vão além da simples priorização de análise de um pedido de registro pós-registro ou realização de
estudos clínicos esses programas abrangem um escopo mais amplo envolvendo um acompanhamento especial do desenvolvimento do produto desde as desde as etapas iniciais da pesquisa e o des volvimento Clínico até aprovação e posterior comercialização no relatório de análise de impacto regulatório as vias de registro e prioridades adotadas pelas autoridades reguladoras internacionais como a fda a ema a TGA e a safra são detalhadas evidenciando estratégias de incentivo ao desenvolvimento e comercialização de medicamentos contudo é essencial ponderar que essas autoridades geralmente operam em contexto de maior disponibilidade de recursos humanos e financeiros que é o que as diferencia
significamente do cenário enfrentado pela Anvisa a FDI a ema possuem estruturas robustas com financiamento estável e equipes especializadas para lidar com designações especiais Como Fast track ou breakth breakth therap a tja e a safra apesar de serem capacidades operacional semelhante a Anvisa em alguns aspectos dispõe de programas de priorização mais restritivos garantindo que apenas medicamentos de altíssimo Impacto sejam contemplados a Anvisa enfrenta restrições em relação ao número de servidores disponíveis para as análises de registro e pós registro de medicamentos e pesquisa clínica o aumento contínuo de petições prioritárias sem agilidade adequada tem sobrecarregado muito quadro
técnico comprometendo a celeridade e a qualidade das análises tanto para a demanda prioritária quanto Ordinárias a escassez de Recursos Humanos implica na necessidade de um sistema de priorização que seja mais equilibrado restringindo a concessão de priorizações a produtos com comprovada relevância para a saúde pública e alinhadas com as demandas nacionais portanto embora as estratégias internacionais forneça uma base valiosa para a modernização regulatória da Anvisa é imprescindível adaptar essas práticas à realidade Nacional levando em consideração a limitação de recursos humanos e operacionais assim o fortalecimento da gestão interna aliada a critérios mais objetivos pode assegurar que
o sistema de priorização continue eficaz e sustentável assim para mitigar os efeitos da limitação de recursos e atender as demandas da saúde pública e da Inovação Nacional a revisão da regulamentação de priorização aqui apresentada é orientada para uma abordagem estratégica e contempla uma revisão do sistema de priorização equilibrada às necessidades de saúde pública e ao incentivo à inovação nacional assegurando que os recursos da Anvisa sejam utilizados de forma eficaz ao vincular a priorização a resultados concretos para a população e ao fortalecimento do setor farmacêutico nacional é possível maximizar o impacto positivo desse mecanismo regulatório mesmo
diante das limitações operacionais da agência certamente a priorização de análise de petições de registro e pós registros de medicamento desempenha um papel crucial em diversas frentes regulatórias com impactos significativos tanto para a saúde pública quanto para a Inovação e economia a priorização acelera o registro de medicamentos estratégicos e contribui para disponibilizar com mais brevidade terapias essenciais à população promove a concorrência proporcionada pela priorização de medicamentos genéricos e vacina favorece a redução de preços e torna os tratamentos mais aceitáveis mais acessíveis beneficiando diretamente os pacientes e otimizando também recursos do SUS já as priorizações das alterações
pós-registro desempenha um papel essencial na melhoria da contínua do processo produtivo e na ampliação das opções terapêuticas disponíveis essa prática ao focar em aspectos específicos como local de fabricação aumento do tamanho de lotes e novas ações terapêuticas contribui de maneira significativa para o fortalecimento da cadeia de abastecimento e para atendimento mais eficaz às necessidades da população acelerar a análise de alterações pós registro ao acelerar a análise de petições pós registro a Anvisa não não apenas contribui para otimizar o processo produtivo e a oferta de medicamentos no Brasil mas também reforça a resiliência do mercado farmacêutico
e amplia opções terapêuticas disponíveis a priorização de anuências ensaios clínicos permite que medicamentos inovadores sejam avaliados e oferecidos a pacientes brasileiros durante o desenvolvimento trazendo opções terapêuticas emergenciais para doenças sem alternativas disponíveis neste caso particular incentivar ensaios clínicos no Brasil promove o desenvolvimento científico local amplia o conhecimento sobre as populações específica e torna o país mais atrativos para investimentos na área de pesquisa clínica assim o mecanismo de priorização de análise não apenas acelera o acesso a medicamentos e terapias mas também gera impacto na qualidade de vida da população brasileira e no fortalecimento do Sistema Único
de Saúde ao fomentar a Inovação e ampliar a concorrência no mercado a Anvisa cumpre seu papel estratégico de equilibrar celeridade e Rigor técnico as petições enquadradas na categoria prioritária conta com o benefício de uma análise mais célere vialar viabilizada pela pela redução de prazo legal conforme disposto na 13411 de 2016 então apenas celeridade em relação aos prazos os dados são todos avaliados e são todos considerados o medicamento priorizado ele é igualmente seguro eficaz e com qualidade Essa é muito importante circundar isso porque não é uma análise sem considerar as evidências científicas essa redução objetiva acelerar
o acesso a medicamentos e Tecnologia de saúde considerado estratégicos sem comprometer os rigores os rigorosos critérios técnicos de avaliação A 204 de 2017 foi fundamental a estabelecer a priorização de petições de registro e p registro e Estudos clínicos de medicamento com impacto significativo para a saúde pública assegurando maior celeridade ao processo de análise com a regulamentação as petições prioritárias passaram a ser tratadas com atenção especial conforme a sua relevância sem comprometer os princípios de idade segurança e eficácia elementos essenciais no processo regulatório da Anvisa entretanto Após 7 anos de vigência da 204 de 2017 foram
identificadas algumas limitações e oportunidades de melhoria no sistema de priorização acrescente demanda por petições prioritárias e a evolução das necessidades de saúde pública e do cenário regulatório aponta para a necessidade de aprimorar a normativa a necessidade de adaptação da regulamentação às novas realidades do setor farmacêutico com avanço nas inovações terapêuticas novos tratamentos biossimilares e genéricos além do crescente papel da indústria nacional e a capacidade produtiva interna Exige uma revisão no processo de priorização além dos critérios já estabelecidos é importante revisar e atualizar e considerar novos parâmetros para garantir a priorização de medicamentos como alto impacto
para a saúde pública especialmente aqueles com com potencial de reduzir custos no SUS e ampliar o acesso a tratamentos inovadores a inclusão de medicamentos estratégicos como os biossimilares e aqui eu queria ressaltar que foi uma discussão muito feita pelo gerente Geral de produtos biológicos por ser um passo importante nesse sentido pois esses produtos podem reduzir custos e aumentar a competitividade do mercado farmacêutico desde a publicação da RDC 204 de 2017 as priorização das petições pela anisa tem sido uma ferramenta importante para acelerar o processo de an de medicamentos e Terapi de relevância paraa saúde pública
no entanto com o passar dos anos a demanda crescente por essa celeridade tem gerado Impacto significativo no fluxo Geral de análise regulatória especialmente das petições ordinária a priorização de centenas de solicitações Tem se tornado cada vez mais frequente que por um lado é positivo pois atende a necessidade de agilidade para medicamentos que demandam análise rápida por outro lado o aumento do número de petições priorizadas tem pressionado o o fluxo de trabalho da Anvisa afetando a capacidade da agência de realizar análise eficiente de outras petições Ordinárias que não são tratadas com a mesma urgência a lentidão
nos processos ordinários pode afetar empresas e produtos importantes que não se enquadra como prioritários comprometendo a previsibilidade regulatória a ampliação da demanda por priorização pressiona a capacidade técnica e logísticas das áreas de análise potencialmente comprometendo os prazos de resposta tanto para as petições prioritárias quanto para as Ordinárias o impacto na análise de petições Ordinárias também reforça a necessidade de ajustes regulatórios e operacionais para assegurar um sistema equilibrado transparente e eficaz o problema regulatório foi definido pela grande quantidade de petições priorizadas em comparação ao total de petições protocoladas o que gerou uma distorção no sistema regulatório
essa priorização ampliada embora desenhada para acelerar dis iação de produtos estratégicos Não tem necessariamente traduzido em maior disponibilidade de produtos paraa população assim um número significativo de protocolos passou a ser classificado como prioritário sem que houvesse um impacto correspondente em termos de acesso efetivo aos medicamentos por parte da população outro problema regulatório relevante surge com a modernização e a Inovação do setor farmacêutico H situações objetivas que estão alinhadas com o desenvolvimento industrial do país e com ampliação do acesso a medicamentos estratégicos mas que não são contempladas pelos critérios atuais de priorização o marco regulatório atual
conforme a RDC 204 de 2017 não contempla explicitamente a priorização de tecnologias inovadoras ou estratégicas que possam ter um impacto significativo no desenvolvimento industrial nacional e na competitividade Global do Brasil Esse aspecto limita a capacidade do sistema regulatório de responder rapidamente às necessidades de inov ação especialmente em um contexto Global cada vez mais dinâmico do setor farmacêutico Além disso O regulamento atual não prevê priorização específica para o primeiro biossimilar aprovado como ocorre com medicamentos genéticos O que é um ponto importante a ser discutido uma vez que os biossimilares têm grande potencial para reduzir custos com
tratamentos inovadores ampliar acesso a terapias eficazes e estimular a competitividade no mercado do ponto de vista da indústria Nacional a priorização do primeiro biossimilar de produção nacional e o primeiro genérico de produção Nacional são questões de grande relevância esses produtos não apenas possuem um potencial de impacto econômico significativo ao reduzir os custos do Sistema Único de Saúde e aumentar o acesso a medicamentos de qualidade mas também podem ser vistos como Marcos importantes no fortalecimento da Indústria Farmacêutica Nacional a produção local de biossimilares e genéricos pode estimular a Inovação tecnológica aumentar a resiliência da cadeia farmacêutica
e contribuir para a soberania sanitária do país atualmente medicamentos com alto potencial de impacto na saúde pública mas que não se enquadram nos critérios vigentes enfrentam o mesmo fluxo de anális de petições ordinária o que pode atrasar o seu acesso ao mercado medicamentos que poderam apoiar política de saúde e desenvolvimento econômicos ficam fora do escopo prioritário prejudicando iniciativas que buscam consolidar o Brasil como um polo de inovação produção farmacêutica a atual regulação também não contempla de forma Clara o papel da agência como catalisadora do desenvolvimento industrial da Saúde isso é muito importante a agência tem
um papel de ser catalisadora no desenvolvimento industrial no setor de saúde a inclusão de critérios que contempla a modernização e a Inovação no setor farmacêutico é essencial para alinhar a regulação da visa com desafios e oportunidades contemporâneos dessa forma ag gente não apenas fortalece a sua missão de proteger a saúde pública mas também contribui para o desenvolvimento industrial do Brasil IMP puncionando o acesso a medicamentos estratégicos e promovendo ambiente de inovação sustentável nesse cenário a revisão e otimização do sistema de priorização São portanto fundamentais para alinhar as intenções regulatórias ao resultado esperado essa abordagem não
apenas reforçará a eficácia do processo como também assegurará que a priorização atenda efetiva aos objetivos de saúde pública promovendo acesso rápido e seguro a medicamentos essenciais incorpore as novas tecnologias permitindo que o Brasil acompanhe as transformações globais no setor farmacêutico e favoreça o desenvolvimento da indústria Nacional a competitividade Internacional e a atração de investimentos estratégicos as melhorias na regulamentação devem ser implementadas sem comprometer análise regulatórias de outras petições igualmente importantes garantindo o sistema I Brado transparente e eficaz que respeite os princípios da qualidade segurança e eficácia que norteiam a atuação da Anvisa nesta esteira o
objetivo geral desse trabalho de avaliação de impacto regulatório e revisão normativa é definir critérios Claros de priorização e um procedimento especial de análise que permita a priorização exclusiva e Total das petições que seja de alta relevância paraa saúde pública com foco em produtos que possam gerar Impacto direto e significativo na proteção melhoria da Saúde confiram flexibilidade necessária ao tipo de medicamento envolvido considerando as particularidades das inovações tecnológicas facilitem o apoio à inovação Nacional garantindo que os produtos estratégicos desenvolvidos localmente ou com potencial de transferência de tecnologia possam ser priorizados aliando as necessidades especialmente do complexo
industrial da saúde e promovendo o desenvolvimento econômico da saúde e aqui diretor Daniel as necessidades do Complexo da Saúde Outro ponto essencial que contempla o objetivo de uma avaliação priorizada é garantir que após a conclusão do registro de medicamento a empresa disponibilize o produto com maior brevidade possível buscando atender de forma eficaz a necessidade da população brasileira não dá né diretor romers pra gente priorizar fazer todo o esforço e o medicamento não vai pro mercado a gente tem discutido muito isso como a necessidade da priorização ela tá diretamente ligada a o acesso Esse aspecto se
relaciona diretamente à celeridade no acesso a medicamentos essenciais inovadores o que exige não apenas uma análise regulatória rápida mas também um compromisso das empresas em assegurar a disponibilidade imediata após aprovação portanto a revisão Visa não só a rapidez no registro mas também a eficiência na produção Distribuição e comercialização dos medicamentos garantindo que a população tem acesso a terapias importantes no menor tempo possível no menor tempo possível principalmente em cenários de urgência sanitária ou de saúde pública dessa forma o sistema de priorização deve integrar não apenas a aceleração do processo de registro mas também garantir o
acesso efetivo ao produto assegurando que a relevância para a saúde pública seja acompanhada de ações concretas que Tragam benefícios tangíveis à população Esse equilíbrio é fundamental para assegurar que os medicamentos prioritários sejam disponibil de forma ágil e eficiente sem comprometer os princípios da segurança qualidade e eficácia e ao mesmo tempo impulsionar a Inovação no país para tanto as áreas técnicas ggm E ggb propõe as seguintes medidas garantir na medida do possível permitir na medida que o possível apoiar na medida que possível que a priorização esteja vinculada à posterior comercialização do produto assegurando a efetiva disponibilização
do produto priorizado isso implica em que os medicamentos e terapias priorizadas não sejam apenas registradas rapidamente mas que também cheguem ao mercado e a população com maior celeridade possível excluída a possibilidade de priorização produtos que não tem alta relevância paraa saúde pública a priorização deve ser reservada para Clara reservada para produtos com impacto significativo na saúde pública como medicamento para doenças urgentes ou emergentes garantindo que os recursos que os recursos e esforços sejam direcionados para que realmente importa paraa saúde harmoniza a estratégia de priorização com a estratégia geral no que tand a saúde especialmente aí
ao fortalecimento industrial da saúde a priorização deve contribuir para o desenvolvimento do setor industrial Nacional incentivando a Inovação e a produção local e a transferência de tecnologia ao mesmo tempo que atende as necessidades de saúde pública apesar do dos pontos destacados pela área técnica gostaria de chamar especial atenção aos meus colegas apesar dos pontos destacados pela área técnica é importante acrescentar que a priorização também deve considerar aspectos como redução dos custos da saúde e ampliação do acesso a priorização dos primeiros medicamentos genéricos e Bi similares desempenha um papel fundamental Nesse contexto pois são terapias comprovadamente
eficazes que reduzem os custos para o sistema de saúde e amplia o acesso da população a tratamentos essenciais relevância Econômica Industrial a priorização deve apoiar o aumento de plantas produtivas no país contribuindo para o fortalecimento industrial da Saúde isso envolve estimular a produção Nacional de insumos farmacêuticos ativos fortalecendo a resiliência da cadeia farmacêutica e reduzindo a dependência de importações abastecimento e enfrentamento de crises sanitárias a capacidade de resposta à crises sanitárias Depende de uma cadeia produtiva robusta E especialmente nacionalizada a priorização de medicamentos e produtos estratégicos que favorece o abastecimento contínuo e o enfrentamento de
Emergências sanitárias é crucial para proteger a saúde em especialmente Em momento de crise a priorização de medicamentos aqui é uma outra especialmente trazido pela relatoria a priorização de medicamentos cujos estudos clínicos fase um dois e três sejam realizados no Brasil é uma medida estratégica que pode trazer benefícios tanto para a saúde pública quanto para o desenvolvimento industrial e científico nacional essa proposta está alinhada com o fortalecimento da pesquisa e inovação local incentiva parcerias entre a indústrias farmacêuticas e o centro de pesquisa no Brasil com essa estratégia de priorização a regulamentação pode não apenas garantir a
celeridade e relevância para atendimento à saúde pública mas também promover um impacto positivo no desenvolvimento econômico na segurança sanitária e na sustentabilidade do sistema de saúde assim a proposta Visa não apenas melhorar a eficiência e a celeridade no processo regulatório mas também garantir que as políticas de priorização sejam Integradas como estratégias do fortalecimento da saúde pública promovendo benefícios sustentáveis para a população brasileira Neste contexto pontuo o projeto de lei 4209 de29 atualmente em tramitação no senado federal que propõe uma importante alteração no processo regulatório de medicamentos no Brasil ao estabelecer que os medicamentos como insumo
farmacêuticos ativos produzidos no país terão prioridade no registro e nas análises da Anvisa também trago que priorizar medicamentos com estudo Clínico 1 do e com fases 1 do 2 e TR locais a Anvisa pode colaborar para reduzir o tempo de desenvolvimento de aprovação de novos medicamentos ao mesmo tempo em que promove a qualificação da pesquisa nacional e fortalece a soberania tecnológica e científica no Brasil essa medida também pode ser um um fator de atração para investimento do setor farmacêutico com a criação de uma infraestr ura de pesquisa de ponta a minuta de consulta pública é
uma proposta robusta que reflete avanços recentes na abordagem da priorização regulatória abordando tanto as necessidades da saúde pública quanto os objetivos estratégicos do desenvolvimento Nacional destaques da proposta foco em condições de saúde prioritária pois prioriza medicamentos destinados ao tratamento das doenças negligenciada condições graves sem alternativas terapêuticas e aquelas de alto impacto epidemiológicos H medicamento relacionados Especialmente às parcerias para o desenvolvimento produtivo e as parcerias para as iniciativas de inovação eh estabelecidas Nos programas nos atuais programas com base na análise detalhada nos estudos realizados e na experiência acumulada ao longo dos anos de trabalho aqui na
avisa identifico com a minuta de consulta pública embora sólida e abrangente pode ser aprimorada com pequenos ajustes que reforçam a sua aplicabilidade e alinhamento estratégico assim os ajustes propostos para minuta de consulta pública visam reforçar o alinhamento estratégico da regulamentação com as demandas de saúde pública e os objetivos do desenvolvimento Nacional garantindo maior incentivo à inovação à produção local conforme se segue então peço peço por favor que leia a minuta Onde se lê artigo 3º inciso inciso 3 medicamento sintético ou semissintético com insumo farmaceutico ativo com todas as etapas de produção desde a introdução dos
materiais de partidas realizados no país leia-se medicamento biológico sintético ou semissintético com insumo farmacêutico ativo com todas as etapas de produção no país para IFA sintético ou semissintético desde a introdução dos materiais de partidas realizadas no país acrescenta aqui que além dos medicamentos sintéticos incluem medicamentos biológicos Onde se lê artigo 3º Inciso 4 medicamento novo fabricado no país ao menos desde a introdução do IFA até a obtenção do produto agranel quee tem um artigo geral sobre a produção de IFA eh leia-se medicamento novo fabricado no país com pesquisa e desenvolvimento e todas as etapas de
fabricação realizadas no país Onde se lê artigo Tero e inciso 7 a primeira petição de medicamento biossimilar nético para para insumo farmaceutico ativo ou produto combinado lei a primeira a primeira petição de medicamento biossimilar inédito para cada insumo farmacêutico ativo ou produto combinado ou a primeira petição de medicamento biossimilar a ser fabricado no país inclusão dos incisos artigo Tero inciso 9 medicamento com desenvolvimento de ensaios clínicos fase 1 2 e truídos pela Anvisa e conduzidos no Brasil inciso primeiro medicamento a ser produzido em uma nova planta Fabril no país artigo 4to que trata das petições
paraas registro inclusão do inciso 9 petições de modificação petição ou petições de modificações pós Registro para os três primeiros medicamentos a serem produzidos em uma nova planta Fabril do do país a proposta aprimorada assegura maior alinhamento com as metas estratégicas da Anvisa e com as políticas públicas de saúde e desenvolvimento industrial uma vez que os ajustes pontuais na minuta de consulta pública vai ao encontro das estratégias para incentivar a produção de local de medicamentos biológicos e sintéticos em todas as etapas promovendo a independência produtiva valorizando a Inovação Nacional ao priorizar medicamentos com ensaios clínicos realizados
no Brasil e o uso da infraestrutura Fabril local fomento o desenvolvimento industrial e incentiva investimentos em novas plantas Fabriz ampliando a capacidade produtiva nacional Neste contexto é evidente que os mecanismos de incentivo a desenvolvimento de medicamentos precisam transceder A priorização de análise ou adoção dos procedimentos especiais uma abordagem eficaz Exige uma estratégia exige estratégias abrangentes Integradas que combinem diferentes instrumentos regulatórios e econômicos a implementação de estratégia integrada amplia significativo o impacto dos mecanismos regulatórios criando um ecossistema que estimula não apenas a celeridade na análise de medicamentos mas também a Inovação a competitividade e o fortalecimento
da Indústria Farmacêutica Nossa Nacional essas medidas são cruciais para que o Brasil atenda as demandas de saúde pública e ocupe uma posição de destaque no Mercado Global de medicamento destaco que as alternativas regulatórias apresentadas no a buscaram alinhar o processo de priorização com os objetivos centrais de saúde pública e inovação Nacional garantindo que os recursos regulatórios da Anvisa sejam direcionadas às demandas de maior impacto contudo as contribuições a ser recebidas durante a consulta pública desempenharão um papel crucial no no aprimoramento do processo de air a consulta permitirá uma ampla participação de diversos atores envolvidos indústria
sociedade civil especialistas e outros entes regulados garantindo que os aspectos práticos e potenciais de potenciais impacto da proposta regulatória sejam bem compreendidos e considerados antes da sua implementação essas contribuições podem identificar lacunas preocupações adicionais ou até mesmo sugerir alternativas mais eficientes para a regulamentação proposta ou que pode ajustar ou alterar a análise de impacto regulatório inicial a consulta pública ferramenta fundamental para transparência qualidade técnica e adequação das decisões regulatórios também permitirá que o processo de air seja aprimorado refletindo melhor os interesses públicos e as necessidades do mercado ela também fortalecerá a credibilidade e a legitimidade
da Anvisa ao ouvir e considerar as contribuições da sociedade do setor e dos regulados nessa direção a agência contribui para viabilização do acesso seguro a produtos essenciais para a saúde da população em convergência com o fortalecimento industrial da saúde que por sua vez busca estimular a produção Nacional de produtos prioritários para SUS e assim reduzir a dependência de medicamentos e vacinas e outros produtos de saúde estrangeiros a revisão da RDC 204 é essencial para assegurar que a priorização de petições continue a ser uma ferramenta eficaz adaptada à realidade atual do sistema de saúde e a
capacidade da Anvisa o processo de aprimoramento regulatório busca garantir a coesão e a a consistência nas decisões da Anvisa evitando a adoção de procedimentos desarrazoados ou díspares que que possam gerar insegurança jurídica ou tratar os entes regulados de maneira desigual além disso a harmonização de entendimentos assegura que as decisões sejam baseadas em evidências técnicas e no cumprimento das normas regulatórias e não em exceções que possam gerar interpretações divergentes essa uniformidade facilita tanto para os entes regulados como para a própria agência garantindo que a Inovação tecnológic os avanços terapêuticos sejam avaliados de maneira Justa e objetiva
sempre com foco no interesse público e na segurança sanitária a continuidade do processo de aprimoramento regulatório é fundamental mas é igualmente importante que o processo seja ágil eficiente e alinhado com o interesse público e as necessidades de saúde da população ao mesmo tempo que fortalece a indústria nacional e promove a Inovação pontuo que as questões questões levantadas no voto T fundamento no air realizado pela ggm reforça a importância de um processo regulatório fundamentado transparente e robusto a portaria 162 de 21 que define diretrizes para análise do impacto regulatório serve como alic para avaliar efetividade proporcionalidade
e adequação das decisões regulatórias mas o papel da diretoria colegiada é basilar para complementar essa avaliação Considerando o cenário global e suas implicações estratégicas ao integrar o air as considerações da colegiada e contextualizá-lo no cenário Mais amplo a Anvisa reafirma seu papel de promover o equilíbrio entre inovação regulatória e proteção sanitária o voto sim fortalece as as bases para o ambiente regulatório mais justo eficiente alinhado às demandas nacionais Assim como as ponderações dos demais diretores sobre o tema aqui vou fazer um destaque Inclusive das alterações que será realizada no air considerando inclusive o compromisso da
da avaliação por todos os diretores mas chama a atenção que dentro dos principais pontos do air tem lá uma questão icamente que deixa dúvida sobre a questão de revisão da 205 então aqui digo que já será melhorada especialmente para deixar claro que a a25 não é objeto desse a da exclusão referente a a 205 de questões mais do ponto de vista dos objetivos específicos lembrar que por vezes nós não conseguimos garantir mas sim facilitar e propiciar e as nossas estratégias elas são alinhadas às estratégias do fortalecimento das políticas públicas de saúde que são muito mais
amplas eh e considerando o país eh especialmente com fortalecimento para a resiliência e enfrentamento de crises e apoio especialmente à saúde pública São contornos que será feitos no próprio er que está no no processo baseado inclusive em contribuições Desde já eu agradeço especialmente ao diretor Daniel que me trouxe os apontamentos e e que são extremamente relevantes por fim depois desse voto enorme para o sucesso e eficácia dessa medida da regulatória é essencial fortalecer a equipe das áreas técnicas estratégicas na Anvisa como a GG Média a GG Bio e a copec o fortalecimento dessas áreas não
é apenas uma necessidade operacional mas uma estratégia essencial para que a Anvisa possa contribuir nossa mãe deiv decidam Nossa desculpa possa contribuir de forma decisiva para o fortalecimento do Brasil assegurando a qualidade de segurança e eficácia dos medicamentos e produtos biológicos disponibilizados à nossa população Esse é um passo indispensável para atender as demandas da saúde pública e promover a Inovação e a competitividade do setor farmacêutico em face do exposto voto pela aprovação do relatório de análise de impacto regulatório com as ressalvas aqui já pontuadas sobre a priorização e procedimento especial da análise de medicamento da
proposta de consulta pública de resolução da diretoria colegiada que dispõe sobre o enquadramento da categoria prioritária de petições de registro pós registro e anuência prévia em pesquisa clínica de medicamentos a princípio propõe uma consulta pública de 60 dias mas entendo que o tema é complexo certamente os senhores diretores que estarão aqui eh vão avaliar a necessidade de ampliar essa consulta pública mas também é uma medida muito esperada pelo setor talvez valesse a pena no primeiro momento 60 dias e avaliar se esse tempo é adequado certamente os senhores diretores que estarão aqui eh poderão avaliar a
posteriore Esse aumento mas a princípio tô propondo aqui consulta pública de 60 dias quero registrar meu agradecimento ao Claudio osvan Martins eu acho que ele ainda tá presente aqui na dicol ao Rafael Sanches ao Fabrício Carneiro bem como parabenizo a todos os servidores que mantm a VISA no patamar de excelência técnica o trabalho dedicado de cada um contribui significativamente para o fortalecimento do ambiente regulatório do Brasil diretamente relacionado à segurança sanitária dos medicamentos e vacinas disponibilizar a população a atuação desses desses servidores reflete o compromisso com a saúde pública assegurando que o Brasil continue sendo
uma referência em regulação proteção da saúde e promoção do acesso seguro e eficaz às tecnologias de saúde e a todos vocês meus colegas servidores minha sincera admiração e gratidão é este o voto que submeto a apreciação e deliberação dessa D diretoria colegiada muito obrigada obrigado diretora meiru coloca o tema em discussão e votação diretor Daniel Pereira Obrigado Presidente cumprimento a diretora meu pela qualidade do voto bem detalhado trazendo a importância da RDC da RDC 204 da sua modernização agora proposta pro nosso cenário regulatório Nacional Eu costumo dizer diretora que O legislador quando optou em trazer
regulação sanitária para uma agência reguladora uma agência de estado né com diretores investidos em seu mandato com autonomia financeira autonomia administrativa ele veio justamente trazer essa visão Essa visão da agência como catalizadora do setor como uma agência que deve em todas as suas atuações em todas as suas ações zelar pelo desenvolvimento sustentável do setor e no e no nosso caso o que que é desenvolvimento sustentável é zelar por cada vez mais produtos mais opções pro sistema de saúde mas sempre mantida a segurança sanitária sempre mantida a nossa a missão de zelar na proteção da Saúde
da população a gente não deve esquecer disso nunca eh em relação à proposta trazida de fato passados 7 anos a gente precisa rediscutir algumas questões que que que são oportunidades de melhoria e que vemos durante os últimos anos alguns Alguns gargalos algumas necessidades de de melhoria na redação trago alguns apontamentos aqui do que foi falado no voto da diretora eh reforço a questão da Saúde pública como sempre trago na minha bandeira entendido da saúde pública como sendo o conceito sanitário da palavra que eh na Anvisa nós zelamos tanto pela saúde pública quanto a saúde privada
como a saúde suplementar aqui a gente zela pelo mercado como um todo não existe um apesar de existirem várias formas de financiamento só existe um mercado de saúde no final das contas eh a necessidade de um alinhamento político de um alinhamento com as políticas do governo só que aqui eu alguns apontamentos que fiz inclusive que foram contemplados pela relatoria foi que não eh encerrámos uma política x y z mas que deixássemos o texto aberto para demais políticas do governo são várias as políticas públicas eh do governo do Ministério da Saúde e dos demais Ministérios então
eh a gente trazia por exemplo a ideia do Complexo sociado da Saúde mas temos a nova a nova política Industrial do Brasil entre tantas outras que nós devemos também guardar relação em todas as atuações e dessa casa como agência de estado a importância do tratamento dos similares que vem né que vem sendo trazido também para essa discussão reforçar aqui diretora meru é uma palavra muito bem-vinda falado pela relatora que é agência como catalisadora desse setor eu acho que essa é de fato é a expressão que deve guardar a nossa atuação aqui afinal de contas com
e um setor cada vez mais robusto um setor Nacional cada vez mais mais presente e com potencial de de fornecer Novos Produtos Isso vai trazer uma melhoria ao sistema de saúde que é no final das contas a nossa missão de proteger e promover a saúde da população trazer também um assunto que não poderia deixar de falar do fortalecimento das pesquisas clínicas do Brasil Quantas vezes a gente tá trazendo temas aqui nessa diretoria visando esse fortalecimento desse cenário cada vez mais importante pro desenvolvimento de Novos Produtos no Brasil então e eh é muito bem-vinda eh a
proposta trazida eu eu faço o reforço diretora que eu em itens como como esse que a gente coloca paraa consulta pública para mim mais importante do que a proposta em si é a discussão que a gente vai ter é a gente ouvir quem de fato são os verdadeiros usuários aqui da agência que é a sociedade brasileira a indústria o Ministério da Saúde o o governo de uma forma geral então eu eu me me permito aqui não entrar no mérito da proposta e já eh tratar isso mais para frente mas acho que o relatório de análise
de impacto regulatório ele veio descrever o caminho que a gente quer seguir um caminho de modernização um caminho de de consenso e um caminho que Visa eh é Todos de mão dadas eh governo agência indústria setor trazermos um cenário cada vez mais positivo pro pro Brasil e paraa saúde brasileira Então feito tudo isso eu sigo na íntegra o voto da relatoria e parabenizo novamente todas as equipes envolvidas na construção do relatório parabenizo novamente o o o Vot da relatora todos os servidores envolvidos na proposta e eu reforço aqui meu compromisso que a gente trate com
a maior cidade possível esse item diretora mesmo eh eh eh você né como fo falado com os diretores que aqui estão fica o nosso compromisso aqui em relação a isso obrigado obrigado diretor Daniel também cumprimento as áreas técnicas envolvidas no tema cumprimento a diretora meiruze e eu digo só estamos tratando de revisão de Norma de priorização porque não temos a capacidade operacional de tratar eh as petições que chegam nessa Anvisa dentro de um prazo razoável né imagina o nosso gestor das diversas áreas que todas as áreas T tem priorizações ele tem três quatro filas uma
dessas filas é a priorização né dout Perfeito João perfeito quando você vai distribuir os processos pros seus técnicos como é que você faz vou distribuir dois da fila ordinária um da fila prioritária outro desse aqui outro desse Ou seja é uma fila que você não tem equipes dedicadas exclusivamente a ela né para tratar com celeridade é mais uma fila da agência Imagina os senhores e num Supermercado né ou numa lotérica onde você tem ali o caixa preferencial né que que atende os idosos pessoas com deficiências e e tudo mais só existe aquele caixa preferencial porque
os caixas ordinários tem filas quilométricas que a pessoa que precisa de um atendimento não pode aguardar se tivesse caixa suficiente nas lotéricas e nos supermercados não precisávamos de fila preferencial se tivéssemos técnicos suficientes na Anvisa não precisávamos de ter tirado técnicos das análises técnicas para poder fazer essa revisão da RDC eh 204 né acompanhando e eh umas notícias sobre sobre e fda e tudo mais sobre a o novo Governo dos Estados Unidos me chamou atenção uma notícia que traz sobre as indicações para o Ministério da Saúde o fda dos Estados Unidos onde ele traz a
seguinte informação informação vou ler rapidamente pros senhores uma frase apenas aqui abro aspas com sede no subúrbio de Maryland fora de Washington vírgula os 18.000 funcionários da fda são responsáveis pela segurança eficácias e tudo mais como em avisa 18.000 nós temos 10000 acho que 18.000 eh não são chegaremos nunca não são necessários né mas 10000 é impossível então cá nós discutindo priorização numa agência que trata de saúde tem algum medicamento que não é prioritário tem algum dispositivos médicos que não é necessário pode ficar na fila aliá de eterno enquanto a gente trata priorizações porque que
não temos capacidade operacional gente pessoas para poder fazer o trabalho para o qual a agência foi designada por lei eu acompanho o voto da diretora meiru declaro aprovado por unanimidade o item 2.5 da pauta com o prazo de 60 dias para manifestação da sociedade passemos ao sorteio de relatoria da matéria relatoria fica sob a responsabilidade do diretor Presidente substituto Dr rson Mota próximos itens 2.6 e 2.7 que serão abordados conjuntamente tratam-se de relatório de análise de impacto regulatório e propostas de consulta pública de resolução da diretoria colegiada para dispor sobre o registro de medicamentos fitoterápicos
e o registro e a notificação de produtos tradicionais fitoterápicos de consulta pública de instrução normativa para dispor sobre proibições e restrições aplicáveis à composição de fitoterápicos de consulta pública de instrução normativa para dispor sobre a lista de agrotóxicos selecionados para análise em fitoterápicos e proposta de consulta pública de instrução normativa para dispor sobre a lista Brasileira de espécies vegetais que podem ser registradas por meio do registro simplificado como produto tradicional fitoterápico relatora diretora Doutora meiros e Freitas eh friso que antes de realizar o chamamento das manifestações orais peço que os inscritos respeitem o os 3
minutos tempo para se manifestarem conforme Foi estabelecido na pauta da reunião convido Então à Tribuna a senhora Luzia Franco toch representante da Associação Brasileira das empresas do setor fitoterápico suplemento alimentar e de promoção da Saúde AB fisa para realizar a sua manifestação oral com a palavra precisa ligar por favor o microfone caros diretores peço que aumentem o som por favor era Agora sim caros diretores senhores e senhoras Bom dia em nome da bfis Associação Brasileira das empresas do setor fitoterápico suplemento alimentar e promoção da Saúde eu agradeço a oportunidade de me manifestar sobre um tema
tão relevante e urgente para o setor fruto de anos de trabalho e discussões há mais de uma década tal questão tem sido pauta de reflexões tanto pela envisa quanto pelo setor regulado a bfis teve a honra de liderar o assunto eh o estímulo a esse debate Em alguns momentos marcantes com destaque a 2012 2020 e mais rec emente quando tal assunto passou a ser parte da agenda regulatória da Anvisa consideramos este um tema amadurecido entre agência reguladora e setor regulado cujo conceito Central já foi adotado pela farmacopéia brasileira desde a sua quinta edição entendemos que
a essência dessa discussão é a convergência regulatória o movimento que promove o alinhamento técnico internacional a adotar práticas princípios e padrões amplamente reconhecidos sem abrir mão da adaptação às necessidades locais sempre que Tecnicamente justificável essa abordagem permite que diferentes medidas eh sejam implementadas para alcançar o mesmo objetivo preservando tanto o poder regulatório quanto a soberania Nacional gostaríamos de destacar o ard do trabalho da gmesp incansável nas discussões com as associações as empresas os os pesquis Ades e outras agências reguladoras e também agradecer a Dra meiru pelo pela abertura ao diálogo e pelo empenho em trazer
esse tema para a pauta refletindo um esforço importante em prol do avanço regulatório a partir dos textos divulgados paraa consulta pública nós redobrarem nossos esforços para conduzir uma análise detalhada dos aspectos relacionados a essa mudança buscando soluções que reduzam os impactos ao mercado e que Garanta uma transição harmoniosa e eficiente para garantir adequada análise e discussões de impacto a a bfis sugere e requer que as consultas públicas sejam disponibilizadas com um prazo de 90 dias para as contribuições pois sabemos que o volume de informações é bastante significativo além de estarmos próximos das comemorações festivas de
fim de ano é essencial contar com a Adesão plena das empresas para alcançarmos o sucesso coletivo enfatizamos Que tal mudança promove o desenvolvimento da fitoterapia do setor produtivo de fitoterápicos ganhando patamares muito mais significativos na representatividade tanto Nacional quanto mundial e por fim mantemos A Equipe técnica das empresas associadas à bfis à disposição para colaborar no processo de construção dessa regulação Obrigada agradecemos a Sen to pela manifestação realizada e convido então A Tribuna senhora Luciana Carrasco representante do Sindicato da indústria de produtos farmacêuticos sindus Farma para então realizar a sua manifestação oral Bom dia a
todos em nome do sindos Farma cumprimento os diretores e servidores da Anvisa bem como a todos que acompanham esta reunião presencialmente ou pela internet oportunamente parabenizo a toda equipe da gmesp pelo empenho na elaboração da análise de impacto regulatório relacionada à revisão das normas de fitoterápico e destaco a importância da aprovação desta CP para convergência regulatória internacional com a legislação da Europa Informo ainda que o sindusfarma avaliará a ir e CP assim que estas forem disponibilizadas pela Anvisa e participará ativamente da consulta pública forço a solicitação dafisa para que seja concedido um prazo maior né
para essa consulta pública devido à complexidade da mesma e por fim agradeço a atenção e ressalto ainda a importância da manutenção do conceito atual de ifav e fitoterápicos para os produtos do legado muito obrigada agradecemos a senhora Luciana Carrasco pela manifestação e passo a palavra diretora relatora D Freitas Obrigada lía de Pronto já agradeço a manifestação da da Luzia da dafisa e também da Luciana Farma e ressalta aqui a participação também do João perfeito gerente da área que trabalhou também na condução dessa norma de já agradeço é o voto 251 eu vou pular muito é
um voto bem bem denso vai est disponibilizado mas eu acho vou ler de forma que a gente entenda especialmente as discussões só as normativas eu nem vou citar mais porque a já me fez a doçura de de trazê-las porque são muitas mas só chamando de novo atenção voto 251 o processo regulatório para atualização dos requisitos para controle de qualidade fitoterápico se iniciou aqui bem falado no ano de 22 pelo termo de abertura do processo administrativo de regulação Tap número 3 com a condição processual de realização de análise de impacto regulatório e consulta pública também idade
de trazer esse tema no Tap dessa forma as propostas hora apresentadas são resultados de 10 anos de discussões com o setor produtivo de fitoterápicos com o ministério da saúde demais Ministérios envolvidos na política nacional de plantas medicinais e fitoterápicos com a farmacopéia brasileira com diversos profissionais especialmente professores pesquisadores nacionais reconhecidos assim como diversas autoridades regulatórias com conforme detalhado no relatório de análise de impacto regulatório disponível no processo e também que será disponibilizado a todos peço desculpa além do air também foi realizado uma forma operantes cada que eu gosto muito acho que valoriza essas discussões a
transparência é binar para discussão da matéria estão sendo tratados conjuntamente dois processos é importante citá-los processo sei 2 25351 900 9005 133/2022 dgo 887 processo 25351 92 454/2020 das propostas apresentadas é modernizar e simplificar o arcabouço regulatório para fitoterápicos no Brasil de forma a torná-lo mais compatível com as especifidades dessas categorias com as especificidades dessa categoria de produtos Isso inclui reconhecer as particularidad dos fitoterápicos do desenvolvimento de registro e comercialização garantindo que a regulamentação esteja mais alinhada com as práticas internacionais em especial as utilizadas na Comunidade Europeia a abordagem reflete uma tendência global de flexibilização
e alinhamento regulatório para fitoterápicos equilibrando Rigor técnico com incentivo ao mercado passo da análise os fitoterápicos sendo medicamentos obtidos de plantas medicinais possuem uma história intrinsecamente ligada à evolução da da humanidade desde os primórdios eles representam das primeiras formas de tratamento de doença seu uso permanece relevante em diversas culturas e sistemas de saúde contemporâneos dada a sua relevância os fitoterápicos devem ser tratados como medicamentos e submetidos a padrões regulatórios que assegurem que os produtos disponíveis no mercado sejam confiáveis e benéficos para a saúde pública a Organização Mundial da Saúde em publicações como as de 2003
2011 2017 enfatiza o papel dos fitoterápicos como alternativa terapêutica de grande importância recomendando que sejam regulados de forma adequada pelas autoridades sanitárias para garantir sua segurança qualidade e eficácia esses aspectos reforça a necessidade de uma regulamentação robusta porém adaptada às especificidades dos fitoterápicos promovendo sua integração nos sistemas formais de Saúde ao mesmo tempo que preserva sua essência e origem natural a política nacional de plantas medicinais e fitoterápicos a pnpm pnpm f instituída em 2006 reflete o compromisso do Brasil em integrar os fitoterápicos ao sistema de saúde de forma segura eficaz e sustentável Seu principal objetivo
é garantir à população o acesso seguro e uso racional de plantas medicinais e fitoterápicos enquanto fomenta a preservação da biodiversidade e o fortalecimento da indústria Nacional o Brasil detentor de uma das maiores biodiversidades do mundo utiliza essa política a PNP pmf como ferramenta para incentivar o Uso Sustentável dos recursos naturais assegurando que a exploração de plantas medicinais respeite princípios ecológicos e éticos é um exemplo de como o Brasil utiliza as políticas públicas para aliar saúde desenvolvimento sustentável e valorização de sua biodiversidade com objetivo de beneficiar tanto a saúde da população quanto o crescimento econômico a
política Visa fortalecer todos os elos da cadeia produtiva desde os cultivos e exportação de plantas medicinais até a produção e comercialização de fitoterápicos isso contribui para a geração de empregos para o desenvolvimento econômico em diferentes regiões do país a Anvisa desempenhou um papel fundamental na construção e implementação da política assumindo como prioridade a regulamentação de toda a cadeia estabelecendo os requisitos para qualidade segurança e eficácia ou efetividade desses produtos fitoterápicos alinhados aos princípios da política a agência busca continuamente ar e aprimorar o arcabouço regulatório para aumentar acesso da população a fitoterapia de qualidade de forma
segura e eficaz desde 2006 várias normas relacionadas a fitoterápicos foram revisadas e republicadas evidenciando o compromisso da Anvisa com a modernização e harmonização dessas das regulamentações apesar disso foram identificadas áreas que ainda necessitam de de ajustes principalmente em relação ao controle de qualidade dos insumos vegetais considerando as práticas internacionais desse modo após longo processo de discussão pública verificou-se como importante a revisão de algumas normas como a instrução normativa 4/24 que trata do guia para o registro e notificação de fitoterápicos adequação da resolução da diretoria colegiada 26 de24 a qual dispõe sobre o registro de medicamentos
fitoterápicos e o registro e a notificação de produtos tradicionais fitoterápicos além de ajuste no formato do modelo do registro simplificado de fitoterápico brasileiro atualmente publicado com como a in2 2014 a alteração Está prevista na agenda regulatório 242 por meio do projeto regulatório 8 8.2 que propõe a atualização dos requisitos para controle de qualidade de fitoterápicos com objetivo estratégico de viabilizar o acesso seguro a produtos e serviços essenciais para a população paraa saúde da população as mudanças discutidas já incorporadas a farmacopeia brasileira representa um avanço significativo na regulamentação de fitoterápicos do Brasil a farmacopeia conforme estabelecido
pela lei 6360 de 76 constitui o padrão técnico legal obrigatório para fabricação e controle de medicamentos no país sendo essencial que suas atualizações sejam refletidas também nas normas regulatórias de de autorização de fitoterápicos industrializados é importante destacar que as alterações propostas no presente processo de revisão normativa já foram amplamente debatidas e incorporadas com outros documentos técnicos e regulatórios publicados pela Anvisa como a farmacopeia brasileira o formulário de fitoterápica da farmacopeia brasileira esse processo de alinhamento reforça o papel estratégico da farmacopeia brasileira com instrumentos essenciais na regulação da qualidade de medicamentos e consolida a da atualização
contínua das normas regulatórias a principal justificativa para a proposta de alteração regulatória reside Na necessidade de tornar o mercado brasileiro de fitoterápico mais competitivo acessível e alinhado às práticas internacionais dados de mercados e comparações internacionais apontam disparidades significativas no número de fitoterápicos autorizados e no preço de aquisição desses produtos no Brasil em comparação a países como da Comunidade Europeia as ações internacionais e dados do mercados aponta que no Brasil apesar da sua biodiversidade possui um mercado de fitoterápicos relativamente pequeno e pouco desenvolvido em comparação ao mercado europeu e de outros países com regulamentação consolidada o
controle de qualidade aplicado no Brasil embora robusto é considerado mais rigoroso que o exigido por outras autoridades regulatórias como as da Comunidade Europeia o que aumenta as barreiras para a produção e comercialização de fitter ápos industrializados no Brasil o relatório de análise de impacto regulatório identifica que o sistema regulatório atual para fitoterápicos no Brasil apresenta dificuldades desproporcionais ao rigor que esses produtos representam a saúde pública as principais críticas aponta para a rigorosidade excessiva do controle quantitativo que cria Barreiras para a entrada de produtos no mercado dificultando o acesso da população a fitoterápicos e limitando o
número de produtos izados no Brasil essas dificuldades contrastam com os com os controles adotados internacionalmente que são mais flexíveis e podem prejudicar a competitividade do mercado brasileiro a proposta de modernização de regulação de fitoterápicos industrializado Visa garantir um tratamento proporcional ao risco para a saúde da população considerando a natureza dos produtos fitoterápicos ao mesmo tempo em que busca aumentar a convergência Internacional e melhorar a eficiência da atuação do Anvisa isso envolve um processo de simplificação e atualização das normas aliando o Brasil aos padrões globais e promovendo maior acesso a esses mercados com objetivo específico como
como os objetivos específicos espera-se a harmonização do conceito de produtos e contoles de insumos vegetais como os como previsto na farmacopéia brasileira padronizados internacionalmente redução do custo na fabricação e no controle de qualidade dos fitoterápicos simplificando o modo de seleção das substâncias definidas para o controle de qualidade ampliando seus limites de variação com base na farmacopéia brasileira promoção da redução dos indeferimentos de autorização de fitoterápicos e o aumento do número de fitoterápicos autorizados no país promovendo um maior acesso a esses produtos assegurando a sua segurança deste modo considerando todas as discussões realizadas no relatório jer
a qual incluiu fortemente também a participação da academia e do próprio setor regulado concluiu-se por uma consulta pública de propostas normativas de registro de fitoterápicos incorporando o conceito de fabricação e controle de qualidade de fitoterápicos já adotado pela farmacopeia brasileira sem a necessidade de adequação obrigatória dos produtos anteriormente autorizados para isso faz-se necessário o estabelecimento de um diferencial nos produtos e que seja realizado um trabalho de conscientização a ser realizado por todos os envolvidos na fabricação de fitoterápicos voltados aos profissionais prescritores e usuários espera-se de dessa maneira que a revisão dos aspectos regulatórios relacionados à
produção do e ao controle de qualidade de fitoterápicos resulta em convergência e aproximação com os requisitos regulatórios internacionais promovendo simplificação e consequentemente maior acesso a produtos Mantena sua qualidade segurança e eficácia ao mercado quanto ao registro simplificado de fitoterápicos relacionado à proposta de revisão da in2 de 13 de Maio de 24 a qual estabelece a lista de medicamentos fitoterápicos de registro simplificado e a lista de produtos tradicionais fitoterápico de registro simplificado é importante salientar que a referida instrução normativa foi publicada de forma complementar RDC 26/24 a qual está sendo revisada com intuito de aproximação aos
conceitos e requisitos internacionalmente aplicados especialmente a fitoterápicos sendo necessária adequações também no registro simplificado a alteração regulatória proposta Visa aumentar a convergência internacional no controle de qualidade dos fitoterápicos descentralizando o controle de qualidade a segurança e eficácia ou efetividade dos fitoterápicos dos marcadores que são substâncias selecionadas para o controle de qualidade dos insumos vegetais assim para essa alteração foi entendido necessário adequar também o modelo atual do registro simplificado o qual é Centralizado nos marcadores a discussão sobre a adequação do controle baseado nos marcadores encontra-se também detalhado no relatório de a realizado pela revisão da RDC
26/24 a previsão normativa quanto ao uso de registro simplificado é feita na na Norma de registro de fitoterápicos como alternativa apresentação do dosser completo de registro contendo os dados solicitados para comprovação de segurança e eficácia desse modo o registro simplificado não é obrigatório para a solicitação de registro de fitoterápicos sendo uma alternativa simplificada prevista pela Anvisa além da necessidade de alteração do registro simplificado em relação à centralização nos marcadores e por convergência internacional foi observada a necessidade de adequação do modelo de informações disponíveis considerando que o formato totalmente padronizado é considerado incompleto a proposta para
regulatória é seguir o modelo estabelecidos nas monografias do comitê do comitê de medicinal de produtos vegetais publicado pela agência europeia de medicamentos as quais são disponibilizadas publicamente acompanhada de um relatório de avaliação que detalha todas as informações disponíveis na literatura técnica e científica sobre insumo ativo vegetal monograf Com referência à literatura consultada especialmente Ema 2024 o novo o modelo proposto já é padronizado no Brasil por meio RDC 26/24 com a complementação da in2 de24 e foi entendido como o mais apropriado para o mercado brasileiro após extensa discussão e basada em estudos técnicos já publicizados seguindo
padrões seguindo um padrão largamente praticado e conhecido internacionalmente podendo suprir as dificuldades decorrentes da vigência da in2 2014 ressaltamos que já foi feito inclus a tradução para língua portuguesa das monografias mais utilizadas no Brasil com autorização especialmente da União Europeia da Ema e publicação no portal eletrônico da Anvisa este modo de trabalho disponibiliza informações completas seguindo o padrão largamente praticado e conhecido internacionalmente podendo suprir dificuldades apontadas no registro simplificado para para possibilitar essa implementação foi necessário Ampla revisão da literatura técnico-científica das espécies atualmente presentes na in2 de 2014 foi feita inclusive uma contratação via chamada
pública CNPQ Anvisa 17/27 pesquisa em vigilância sanitária para a revisão de dados técnicos científico para para atualização e inclusão de novas espécies vegetais no registro simplificado de fitoterápico o objetivo da contratação foi os dados apresentados pelos Consultores foram avaliados pela equipe técnica da gesp e posteriormente revisado pelo setor produtivo por meio das diferentes associações de entidades que representam os fabricantes do insumo farmacêutico ativo vegetal e de fitoterápicos assim façam um recorte abifina abfa abif acessa alanac grupo Farma Brasil cind Sis cind fargo sinfar Rio de Janeiro e sindusfarma para ser em seguida submetida e avia
avaliação e consulta pública considerando Considerando que as mudanças propostas entre o formato anterior e o novo a ser padronizado para registro simplificado propõe que o novo formato a ser tratado se se aplique apenas a Novos Produtos a serem autorizados após a sua publicação assim como Regra geral adequações adequações não serão necessárias a não ser que em casos muito específicos verifique se um produto possa trazer aos usuários conforme prever na 6360 de 76 com a adoção do novo modelo que disponibiliza informações completa de segurança eficácia ou efetividade serão reduzidos além dos riscos relacionados ao modelo atual
a carga regulatória da necessidade de complementos de informações para folhetos informativos bula e rotulagem de fitoterápicos aumenta e adequação do registro simplificado de fitoterápicos como Alternativa de simplificação dos requisitos para comprovação da segurança e eficácia sua efetividade juntamente ao fortalecimento das notificações de fitoterápicos estão intimamente relacionados ações de simplificação da carga regulatória e facilitação do acesso a Novos Produtos especialmente ao mercado brasileiro que vem sendo feito constantemente nos últimos anos pela Anvisa assim são apresentadas uma proposta de RDC que viria substituir a atual Norma para o registro e notificação de fitoterápicos o RDC 26/24 e
tr se propostas de instruções normativas que complementam essa Norma principal uma que trata de registro simplificado conforme discutido outra de restrições aplicáveis a registro de notificações fitoterápicos e uma última que seria a lista de resíduos de agrotóxicos a serem avaliadas em espécies vegetais cultivadas no Brasil ressalto que essas Essas duas últimas en citadas possui conteúdo muito semelhante ao texto atualmente vigente os Quais aos textos atualmente vigentes os quais são são atualmente publicados como anexo RDC 26/24 porém após discussões técnicas optou por desmembrar-se em vigência e em consulta pública após a consolidação da Norma para o
registro e notificação de fitoterápicos a qual deverá revogar a in4 de24 atualmente vigente serão disponibilizados também para contribuição pública por meio de edital de chamamento modelo este escolhido considerando a tecnicidade e a a tecnicidade e a a enormidade dos texos técnicos relacionados a Registro simplificado incluindo as monografias de registro simplificado seus respectivos relatórios de avaliação além de pareceres elaborados pelos especialistas contratados especialmente sobre a possibilidade de novas inclusões no registro simplificado ou sobre a necessidade de exclusão de determinada espécie vegetal esses documentos são resultantes de anos de discussão com o setor produtivo com outras áreas
da Anvisa relacionados relacionadas também com a academia científica com o Ministério da Saúde representando a gestão da política nacional de medicamento fitoterápico e com a a a população a qual já pode participar por meio de webinário específico realizado sobre esse assunto além de vários outros eventos os quais estão detalhados em mais de 600 páginas anexadas ao relatório de air espera-se que a revisão dos aspectos regulatórios relacionados à produção e ao controle de qualidade fitoterápica que eu queria fazer um ponte Eu falo sempre que nós temos uma a a nossa regulação e tudo que nós trabalhamos
a gente fala eh em uma regulação científica em evidência científica os nossos relatórios de de air por vezes é quase uma mais do que uma tese de doutorado espera-se que a revisão dos aspectos regulatórios relacionados à produção e ao controle de qualidade fitoterápico resulte em convergência e aproximação com os requisitos regulatórios internacionais promovendo maior acesso a produtos de qualidade segurança e eficácia no mercado brasileiro a atualização das das das resoluções é fundamental para que a VISA possa continuar cumprindo o seu papel de garantir a segurança sanitária e promover o acesso seguro a medicamentos fitoterápicos ao
às normativas de fitoterápicos demonstra seu compromisso em incorporar novos conhecimentos científicos e regulatórios reforçando a confiança do público e do setor regulado nas suas diretrizes essa evolução regulatória é essencial para enfrentar os desafios contemporâneos especialmente de diante das rápidas evoluções científicas assim as propostas representam um papel estratégico para equilibrar a segurança e eficácia dos fitoterápicos com a facilidade do acesso e desenvolvimento do Mercado Nacional o alinhamento com as práticas internacionais contribuirá para dinamizar o setor fomentar a Inovação e melhorar o acesso da população brasileira mas é apenas uma parte do esforço Mais amplo necessário para
superar os desafios estrut do setor investimentos em pesquisa inovação clareza na legislação e especialmente de biodiversidade Aliados a parceri serão essenciais para consolidar um mercado de fitoterápico robusto e acessivo no Brasil com a implementação das mudanças espera-se que a indústria Nacional de fitoterápicos seja mais competitiva com produtos mais acessíveis à população e que o sistema regulatório brasileiro se torne mais eficiente promovendo o ambiente mais favorável para inovação e para a expansão do mercado de fitoterápicos no país a simplificação do controle de qualidade e a redução dos custos também tem o potencial de gerar benefícios econômicos
estimulando o crescimento do setor e a atração de novos investimentos para indústria de fitoterápicos no Brasil ao concluir destaco que no desenvolvimento deste trabalho é fundamental ressaltar a construção coletiva que envolveu diversas contribuições especialmente as lideranças e os trabalhos conjuntos das equipe um destaque especial vai paraa servidora Ana Cecília Bezerra que se tornou uma referência tanto Nacional quanto internacional no campo de fitoterápicos sua expertise e dedicação foram essenciais para guiar e fundamentar as discussões técnicas E normativas além disso O gerente João perfeito também desempenhou um papel de liderança expoente coordenando e promovendo as ações necessárias
para que o trabalho alcançasse os objetivos desejados facilitando a implementação das mudanças e garantindo que as soluções apresentadas fossem viáveis dentro do contexto regulatório não menos importante reconhecer as contribuições de todos os colaboradores cujo empenho coletivo permitiu que o tema fosse devidamente apresentado nessa Diretoria colegiada da Anvisa a colaboração entre os envolvidos foi essencial para a elaboração e apresentação de uma proposta sólida e alinhada com as melhores interesses da saúde pública bem como para garantir que o Brasil avance na regulamentação dos fitoterápicos com qualidade e segurança a atuação desses profissionais e a união dos esforços
são um reflexo do compromisso com a Inovação e melhoria contínua na regulamentação de fitoterápicos garantindo que os produtos no mercado atenda as exigências de segurança e eficácia promovendo o desenvolvimento da indústria Nacional assim Diante do exposto voto pela aprovação do relatório de análise de impacto regulatório e das propostas de consulta público de resolução da diretoria colegiada para dispor sobre o registro de medicamentos fitoterápicos o registro e a notificação de produtos tradicionais fitoterápicos de consulta pública de instrução normativa para dispor sobre proibições e restrições aplicáveis à composição de fitoterápicos de consulta pública de instrução normativa para
dispor sobre a lista de agrotóxicos selecionados para análise em fitoterápicas e de consulta pública de instrução normativa para dispor sobre a lista Brasileira de espécies vegetais e podem ser registrados por meio de registro simplificado como produto tradicional fitoterápico pelo prazo de 90 dias queria lembrar aqui que no meu voto conta várias referências científicas e Muitas delas são dos servidores da Anvisa os quais me orgulha muito muito obrigada diretores é esse o voto que submeta a apreciação dessa DTA colegiada Obrigado diretora meiru coloco de pronto o temo em discussão e votação com o diretor Daniel Pereira
Obrigado Presidente cumprimento a diretora meru pela qualidade do voto digo que hoje é um dia especial diretora por fitoterápicos no Brasil quero parabenizar todas as áreas da Anvisa também envolvidas na construção desse relatório na submissão da consulta pública destacar o passo importante que a gente tá dando alinhado a política a programa A política nacional e o programa de plantas medicinais fisioterápicos reforçando cada vez mais o nosso compromisso com o for da saúde pública e sustentabilidade do setor destacar também que essas mudanças além de simplificar as regras incentivar a Inovação significa cada vez mais opção terapêutica
e acessibilidade paraa sociedade brasileira Parabéns toos desenvolvidos sigo na íntegra relatoria Obrigado diretor Daniel eu cumprimento e agradeço as manifestações orais da senhora Luzia Franco dafisa da senhora Luciana Carrasco do sos Farma cumprimento tamb bem as áreas envolvidas no tema e a relatoria acompanho o voto da diretora meiruze declaro aprovado por unanimidade os itens 2.6 e 2.7 da da pauta e o prazo para consulta pública é de 90 dias passemos ao sorteio de relatoria da matéria a relatoria fica sob a responsabilidade do diretor presidente Dr Antônio barra Torres próximo item 2.8 propostas de resolução da
diretoria colegiada para dispor sobre o regulamento para a realização de ensaios clínicos para fins de registro de medicamentos no Brasil e de instrução normativa para categorizar risco e complexidade do ensaio clínico e do medicamento experimental e definir as autoridades regulatórias estrangeiras equivalentes para análise otimizada de petições da coordenação de pesquisa clínica em medicamentos e produtos biológicos relatora diretora D meiru Freitas convido à Tribuna o Dr Thiago de Moraes Vicente representante da Associação Brasileira das indústrias de medicamentos genéricos e biossimilares prog genéricos para realizar sua manifestação oral Prados diretores Daniel Meireles procurador Geraldo Anvisa Fabrício Oliveira
nosso diretor Presidente substituto rson mota e nossa querida diretora meuso de Souza Freitas sem deixar de esquecer a secretária geral da mesa a senhora Lilian Pimentel e demais aqui assessores que nos acompanham eh vou tomar Liberdade aqui de ler o o a minha sustentação para não incorrer em nenhum tipo de de incongruência ou erro mas antes de mais nada de agradecer a oportunidade eu queria eh dizer aos caros diretores diretores que estendo meus votos de agradecimento e reconhecimento aos servidores da segunda diretoria em especial a coordenação de pesquisa clínica de medicamentos e produtos olgos a
copec não só pela competência mas também pelo zelo do presente tema a adaptação e a regulamentação vigente a práticas mais modernas baseadas em evidências científicas robustas eh permitirá uma maior eficácia na condução dos ensaios clínicos garantindo ao mesmo tempo a segurança dos processos esse esse direcionamento reforça o compromisso com a segurança e a eficácia além de padronizar em especial as práticas de ensaios clínicos o que favorece a confiabilidade e aceitação de medicamentos no mercado em especial a revisão também facilita o processo regulatório para biossimilares através da prática de confiança regulatória reliance para aprovar certas petições
e da classificação de categorias de riscos a redução de tempo de de aprovação promove maior agilidade para a introdução destes medicamentos no mercado que impacta positivamente a concorrência reduzindo custos dos medicamentos para o sistema de saúde e para os consumidores também estas mudanças ao se alinharem com os padrões internacionais e adotar diretrizes de boas práticas clínicas e fabricação eh garante que os medicamentos genéricos e biossimilares tenham a sua qualidade assegurada esse avanço favorece o acesso a medicamentos essenciais ampliando operações as opções terapêuticas disponíveis para a população e fortalecendo como um todo o sistema de saúde
do nosso país em nome da prog genéricos em nome dos nossos Associados agradecemos a atenção e como sempre ficamos à disposição para promover a ciência e garantir um maior acesso aos medicamentos no nosso país mais uma vez agradeço muito Obrigado agradecemos ao Drago Vicente pela manifestação e convido à Tribuna A D tacara representante da associação da Indústria Farmacêutica de pesquisa interfarma para realizar sua manifestação oral muito obrigada Prados senhores e senhoras diretor Presidente substituto romon Mota diretora meiru Freitas diretor Daniel Pereira e procurador chefe Fabrício eh Oliveira Braga e secretária geral da decol Bom dia
a interfarma a interfarma associação da Indústria Farmacêutica de pesquisa entidade que representa 42 Laboratórios os farmacêuticos globais focados no desenvolvimento de novas terapias em saúde agradece a oportunidade de se manifestar em relação ao item 2.8 da hop 23 de 24 e se manifesta favoravelmente à proposta de revisão da RDC número 9 de 2015 que dispõe sobre o regulamento para a realização de ensaios clínicos com medicamentos eh no Brasil a interfarma participou ativamente da CP 1257 de de 2024 e posteriormente realizou o evento regulatório em Foco pesquisa clínica com participação de representantes da copec diri do
na qual a entidade apresentou seus principais pleitos em relação à proposta de CP Tais propostas foram ratificadas por meio do Ofício número 7224 protocolado em setembro de 24 o primeiro pleito eh consistiu na antecipação de todas as importações de medicamentos e suprimentos clínicos antes da publicação da decisão final da Anvisa entende-se que o novo texto pós CP e especificamente o capítulo 10 da importação dos produtos sobre investigação contempla a proposta da interfarma e poderá permitir que o prazo médio de ativação dos centros ou seja o intervalo entre a liberação Global do protocolo Clínico até o
centro ser ativado seja menor do que 5 meses isso é extremamente importante eh para tornar o Brasil atrativo atrativo no cenário global de pesquisa clínica é importante destacar que os produtos sobre investigação ficam sob responsabilidade do patrocinador até que haja uma decisão final da da eh da Anvisa sobre sobre esse pedido o segundo pleito consiste na edição de ato normativo para definir as autoridades reconhecidas azares para fim de procedimento otimizado de análise por reliance tal pleito está sendo também está sendo contemplado por meio da da da in eh que está sendo deliberada nesse momento o
reliance pode ser entendido como ferramenta que auxiliará a Anvisa no cumprimento dos prazos dispostos na lei 14 874 de 24 assim a sua atualização assim a atualização mais célere da da lista de autoridades reconhecidas pela Anvisa quando for identificada a necessidade é extremamente importante por fim outro pleito importante que foi acatado com a nova proposta de texto é a possibilidade de enquadramento em procedimento otimizado de análise das das petições protocolizadas na VISA em data anterior a publicação desta resolução hem em análise pela dicol permitindo Que processos protocolados após a revogação da RDC 601 de 22
possam se beneficiar da ferramenta de reliance Diante do exposto interfarma parabeniza os esforços dessa agência especialmente da copec dir2 eh e agradece o reconhecimento de alguns dos principais pleitos e considerações da interfarma a fim de melhorar e promover o ecossistema de pesquisa clínica no Brasil atualmente a etapa de pesquisa clínica movimenta mais de 139 Bilhões de Dólares por ano em todo o mundo o setor farmacêutico investe mais de 30% do seu valor agregado bruto em pid e esta atividade emprega diretamente 1.1 milhões de pessoas ao redor de todo o mundo assim um investimento na melhor
do ecossistema de pesquisa clínica no Brasil é fundamental para a melhora da economia para geração de empregos para melhorar o ciclo eh Virtuoso da Inovação e por fim permitir mais acesso a novas tecnologias e tecnologias inovadoras aos pacientes brasileiros muito obrigada obrigada Dra Luciana tacara pela manifestação convido A Tribuna o servidor Cláudia osvan Martins Alves de Souza coordenador de pesquisa clínica em medicamentos e produtos biológicos para realizar a apresentação técnica bom eh Primeiramente Bom dia a todos senhores e senhoras eh sou Cláudio osvan atualmente coorden coordenação de pesquisa clínica e medicamentos produtos biológicos eh gostaria
inicialmente de agradecer por essa oportunidade né de trazer um tema que nos é tão caro e acho que caro a todos porque a pesquisa clínica é a passagem obrigatória paraa maior parte eh das inovações em saúde então eu vou fazer aqui tentar aqui ao máximo me desdobrar para fazer essa apresentação ainda que o tema seja muito complexo dentro desses minutos aí me foram dados eh sou eu que bom eh só resgatando um pouco de histórico a revisão da RDC 9 que é de 2015 e que portanto agora em 2025 completam eh completam 10 anos então
Eh ela entrou na agenda regulatória de 2021 2023 mas obviamente por conta da pandemia né nós tivemos que eh desacelerar um um pouco e aí nós transferimos para eh ar 2024/2025 né é durante esse período nós fizemos uma série de interação com o setor E aí eu destaco aqui não é um diálogo setorial que a gente fez em outubro de 2022 reunindo aí as seis eh eh entidades representativas do setor que foi muito importante para eh paraas discussões a respeito da proposta em março nós publicamos então aprovada aqui por essa eh essa diretoria por essa
decol eh o relatório de air E aí o relatório de air traz como conclusão né de que a regulamentação atual RDC 9/25 ela não estabelece hoje critérios ou não está focada numa análise baseada em risco Esse foi o principal eh eh problema regulatório identificado e portanto todo o movimento toda a discussão que se se fez até então foi para que a norma passasse a levar em conta a avaliação baseada em risco é importante destacar né que eh em se tratando de inovação uma Norma que está vigente durante 10 10 anos então ela acaba perdendo muito
e se tornando obsoleta ao longo do tempo porque a Inovação é algo vivo acontece o tempo inteiro eh e todo o mundo as aor as principais autoridades do mundo estão se movimentando nesse sentido de melhorar o ambiente regulatório justamente porque eh a pesquisa clínica é competitiva Portanto o país eh que tiveram um melhor ambiente regulatório obviamente vários fatores são levados em conta eh paraa escolha de um país mas eventualmente os países que conseguirem eh permitir esse ambiente fornecer um ambiente eh eh favorável eh certamente serão os países escolhidos aí eu convido a todos a os
que gostarem desse tema recentemente ailva não é que é uma empresa especializada em emem dentro dentre outras coisas em não é é divulgar dados e de inteligência regulatória e outros né trouxe um Panorama bastante importante sobre o movimento que há no mundo sobre os critérios de priorização de escolha de países para realização de pesquisa clínica foi publicado agora em Julho né de 2024 então convido a todos eh darem uma olhada bom é sobre a a a consulta pública né que foi realizada eh a a consulta pública 1257 de 2024 ela ficou a disponível por 45
dias né nós tivemos 240 eh contribuições não é E aí eh Vale destacar que esse número poderia ser muito maior como é normalmente em se tratando de uma é tão complexa mas nós fizemos um trabalho muito extensivo e intenso ao longo das discussões justamente com todos os interessados o setor né como um todo e com isso eh nós o que restou para a consulta pública foram pontos realmente eh pontos que não tinham sido tratados né ou de alguma de algum modo que precisava de algum aperfeiçoamento enfim aqui para destacar então Foram 18 respond sendo 16
do setor né de pessoa jurídica e aí a a resposta à pergunta se você é a favor eh da proposta e a gente observa que a maior parte não respondeu mas de qualquer modo quando perguntamos eh perguntamos sobre a percepção de né do impacto a maioria respondeu que é absolutamente positiva não é e quem respondeu positivo e negativo pelo que a gente pode observar o fato de ter eh se posicionado dessa maneira que alguns pontos eh não foram contemplados né da maneira como eh eh os respondentes gostariam e obviamente a gente sabe que uma Norma
ela é o é o melhor possível que a gente consegue mas nunca conseguiremos eh contemplar a todos bom aqui eu destaco alguns pontos importantes alguns deles já muito eh já eh eh mencionados aqui eh São dois pontos principais quando nós falamos sobre ponto de vista eh de avaliação eh sobre critério de risco e aqui nós resgatamos o relice né absolutamente consolidado conhecido e e enfim eh o reli eh desde 2012 a a copec em 2012 a copec já tinha publicado o instrumento normativo falando em reconhecimento no instrumento ou no mecanismo de confiança regulatória embora aquela
época não se falava tanto em reli assim como hoje nãoé mas já se aplicava não é em 2012 é RDC a RDC 36 nãoé e de lá para cá nós tivemos E durante todo esse período né inclusive na pandemia RDC 601 RDC 573 que foram revogadas em maio deste ano né E durante o período de vigência dessas duas normas nós tivemos eh cerca de 40% das pesquisas Clínicas eh aprovadas com base em confiança regulatória o outro o outro mecanismo eh que nós trazemos é o a avaliação com base risco baseada em risco apoiada pela experiência
de uso do medicamento E aí nós estamos falando essencialmente não é de medicamento já registrado seja aqui ou em outros países e que portanto sobre ponto de vista de segurança nós já conhecemos temos o perfil e desses desses medicamentos que por hora ou por vezes são reposicionados ou para novas indicações ou novas associações enfim e aí eu destaco especialmente o desenvolvimento Nacional não é que eh desenvolve bastante e eh associações bom eh aqui tanto um quanto outro nós não estamos falando em supressão de documentos nós estamos falando né de dispensa de análise a princípio de
um ou outro documento no caso por exemplo de risco baseado avaliação de risco baseada na experiência de uso nós estamos falando que por ser já por vezes o medicamento já utilizado por vezes já registrado né Por exemplo o o dossier de qualidade do medicamento de produção eh pode ter a dispensa de análise e aí assim por diante só para dar um exemplo né bom outra mudança bastante importante isso foi eh o alinhamento com a ardc a a lei né 14 874 que foi eh eh publicada agora em Maio de 24 passou avalia a partir do
último mês de agosto dia 26 e é é essencialmente em relação ao prazo de 90 dias a lei Traz esse prazo é um prazo Tácito a partir do qual não havendo manifestação da agência dentro desse prazo que o ensaio Clínico poderá ser iniciado obviamente desde que eh autorizado pela Instância ética eh aqui é importante é destacar que eles O legislador aqui Colocou exatamente petição primária e nós sabemos que petição primária e secundária tem uma definição própria navisa para além Desses desse termo eles haviam utilizaram outros termos que são próprios na das nossas rdcs em en
fim e nós aconselhamos que eles não não deixassem tal como foi proposto eh porque são mutáveis né o são termos que a gente hora ou outra modifica por uma revisão de Norma e tal eem se tratando de uma lei Mas chegamos num num consenso de que deixar a petição primária eh seria adequado mas para além da petição primária nós estendemos esse prazo de 90 dias para as petições secundárias Quem são elas são emendas a protocolos clínicos ao alteração de produto e do produto sob investigação por exemplo porque nós entendemos que havendo um prazo de 90
dias não é eh para um protocolo Clínico por exemplo eh ter um prazo maior para uma alteração desse protocolo anularia esse benefício né ter um prazo de 180 dias por exemplo como é hoje para uma alteração de um protocolo que foi aprovado dentro de um prazo maior acabaria anulando esse benefício Perdão bom outro eh outro outra alteração também muito importante foi em relação a essa antecipação da autorização eh paraa importação né dos insumos e aqui não só do medicamento experimental e Placebo e comparadores mas também dos insumos envolvidos dos insumos que serão utilizados na pesquisa
clínica então a a proposta Como já eh mencionada aqui pela interfarma é que eh em 30 dias a partir da data de submissão do do ddcm que é o dossier desenvolvimento Clínico do medicamento que a gente autorize por meio desse documento de importação a importação do dos insumos clínicos né Eh nós discutimos esse tema eh em mais de uma oportunidade com com com área de portos e aeroportos a paf enfim e e e concluímos né em conjunto de que não havia eh riscos mai maiores em relação a esse procedimento né de antecipação eh do da
importação eh desde que cumpridas algumas regras e aqui nós colocamos as regras eh eh na Norma que é justamente o medicamento ou todo o insumo importado ficar sob guarda ou sob responsabilidade do patrocinador não é e e que ele só pode distribuir esse produto esses insumos pros centros após a e publicação eh do da aprovação do do estudo clínico é importante destacar aqui já por fim que hoje em torno de 99% das pesquisas Clínicas São aprovadas né então o risco é de ter que destruir ou devolver algum desses insumos algum desses medicamentos experimental É de
fato é bem baixa e hoje de certa maneira nós temos em torno de 10 a 12% Cent de cancelamentos de estudos né que eh as empresas os patrocinadores já fazem isso né ou devolvem ou destróem e aqui na Norma além da para além da responsabilidade por esses produtos pela guarda desses produtos as empresas deverão nos informar notificar sobre quais providências foram tomadas em relação a esses insumos se eventualmente os estudos forem eh indeferidos ou reprovados bom aqui eu trago uma fotografia da nossa fila hoje né e é bastante eh eh eh digamos grave né so
ponto de vista de pesquisa clínica como eu disse a pesquisa clínica eh competitiva E hoje nós temos 272 petições na fila né e somadas eh 120 que são eh propriamente de estudos clínicos mesmo né de de de protocolos clínicos 95 emendas e 57 que são alterações de qualidade então emendas geração de qualidade são as petições secundárias nãoé então isso somado vai dar 272 petições sendo que 26% delas são eh priorizadas e isso vem de encontro às falas iniciais né da da D meu eh e 81 delas dessas 272 já estão fora do para 30% né
já está fora do prazo sendo que 21 dessas 81 já estão aá mais de 200 dias na fila e se 69 petições estão em análise em diferentes estados seja em análise Inicial ou análise de cumprimento de exigência ou em exigência eu destaquei aqui o artigo 91 porque para além do prazo de 90 dias que a lei propôs ela também estabeleceu uma única exigência eu peço desculpa que eu pulei essa parte lá ela estabeleceu uma única exigência pelo eh pela nossa experiência nós Ainda temos eh desenvolvimentos clínicos processos que tem mais de uma exigência eh de
modo particular né os o desenvolvimento Nacional ainda tem e essa exigência única traz um desafio muito grande porque eh eh eh levaria o indeferimento após a primeira exigência então nós estamos trazendo também lá no artigo 91 algumas possibilidades né de aconselhamento de apoio e aí trazendo também a questão eh do do complexo né de de de de saúde do da da política do governo enfim de desenvolvimento nacional para também dar esse esse aconselhamento esse apoio não é antes de de submeter antes da submissão desses processos de modo que reduza a chance de terem exigências bom
a instrução normativa é sobre aqueles critérios também já foi dito aqui Quais são as áreas não é que nós reconheceremos a instrução normativa trará essa lista e também sobe eh eh o que nós consideraremos como ensaios complexos né para fins de avaliação baseada em risco nós também estamos trazendo esses critérios na instrução normativa por isso ela está Ela está vindo junto com a RDC Muito Obrigado agradecemos ao coordenador de pesquisa clínica em medicamentos e produtos biológicos Dr Cláudio svan Martins Alves de Souza pela explanação realizada e passo a palavra à relatora da matéria diretora D
Mir Freitas Obrigada inici também agradecendo as manifestações especialmente do genérico no nome Doo mora interfarma Luciara E especialmente agradecimento apresentação feita pelo clud vai mear questes trazidas noot eu entação ao relatório do voto é o voto 250 de 2024 aqui eu acho importante eh salientar que as normativas em análise foram propostas pela coordenação de pesquisa clínica especialmente aqui a copec vinculada à segunda diretoria devido a competência regimental Esses são produtos de processo regulatório iniciado em dezembro de 21 aqui como foi colocado eh precederam análise apresentação dessa análise a questão do air consulta pública queria lembrar
que nos termos do voto suado especialmente o voto 96/24 da dir2 quando da consulta pública que abrangeu toda a motivação para revisão normativa vigente Assim como as mudanças que estavam sendo propostas para o processo de avaliação dos ensaios clínicos com medicamento nos termos desse voto a rc9 ao ser publicada promoveu avanços de avaliação do desenvolvimento Clínico de um medicamento incluindo parte da qualidade do medicamento experimental o plano de desenvolvimento além de trazer maior previsibilidade quanto aos prazos de análise mas nesses quase 10 anos de vigência como bem colocado aqui os avanços na área de pesquisa
clínica E especialmente o aprendizado da pandemia nos trouxeram a necessidade de aprimoramento da regulação com foco no risco permitindo otimizar racionalizar ações de regulamentação da regulamentação levar um ambiente regulatório mais favorável pesquisa clínica tudo sem comprometer a qualidade segurança e eficácia dos medicamentos experimentais assim queria chamar atenção que as propostas de minutas de RDC e instrução normativa foram submetidas à avaliação jurídica da procuradoria federal junto Aisa que se manifestou por meio do parecer 184/2022 pela juridicidade da minuta de RDC e da minuto de n ressalvados os apontamentos e recomendações do item 12 15 a até
o 34 do parecer que serão também discutido no decorrer desse voto assim finalizo esse relatório e destaco portanto que as minutas em pautas são produtos de um extenso processo regulatório refletem a oportunidade da melhoria da modernização do marco regulatório sanitário da pesquisa clínica identificado nesses quase 10 anos de vigência da RDC 9 de 2015 a parte da consulta pública praticamente com todas aí as apresentadas e discutidas pelo na apresentação do Coordenador Cláudio osvan mas eu queria lembrar do ponto de análise em relação à análise jurídica que foram realizadas especialmente no item 12 do parecer 184
o órgão jurídico recomendou que fosse avaliado pela área técnica as questões enfrentadas em outro parecer jurídico exarado pela procuradoria federal especialmente o parecer 188 referente a uma consulta feita pela copec a respeito da interpretação e da aplicabilidade da Lei 148 874 de 2024 a recomendação foi para que que se fosse o caso e estendesse pertinente a copec procedesse adequação da minuta de RDC a copec avaliou os pareceres e considerou os apontamentos da procuradoria para minuta hora em debate das alterações após a consulta pública faço destaco nesse voto a mudança em relação ao artigo que trata
da emissão de documento para importação também representado aqui nas discussões trazidas na apresentação para avaliar a proposta do setor foram considerados fluxos de das importações atuais as responsabilidades dos entes da cadeia em relação ao cumprimento das normas de importação e o histórico das petições avaliadas pela Visa frente às análises realizadas concluiu-se por acatar as contribuições realizadas a antecipação da autorização de importação de produtos do produto sob investigação e de outros insumos clínicos com estabelecimento de medidas de controle quanto à distribuição armazenamento e destinação dos produtos sobre investigação também citado aqui especialmente na fala do Cláudio
Osan importante enfatizar que é responsabilidade do patrocinador distribuir os produtos sob investigação apenas as instituições informadas no formulário de apresentação de ensaios clínicos contido no dossiê específico para cada ensaio clínico e autorizadas pelo comitê de ética e pesquisa assim é responsável também pela essa destinação final dos medicamentos inclusive o comitê de ética e produtos que não foram utilizados no ensaio Clínico passo a análise inicio essa análise referenciando a promulgação da Lei 1487 4 de 28 de Maio de 2024 que dispõe sobre a pesquisa clínica com seres humanos e institui o Sistema Nacional de ética em
pesquisa com seres humanos O que representa um avanço significativo na regulamentação de ensaios clínicos e inovação no Brasil com a lei o arcabo regulatório sanitário e ético existente para pesquisa clínica com seres humanos no país passa a dispor de um instrumento normativo superior hierarquicamente específico fortalecendo o ecossistema da pesquisa Nacional garantindo maior segurança jurídica e ética para os estudos com seres humanos esse Marco Legal Vem contribuir com a modernização da infraestrutura regulatória nacional e estabelecer bases para promoção de um ambiente favorável à inovação e a competitividade no do Brasil no cenário global de pesquisa clínica
o termo pesquisa clínica agora conceitualmente disposto em meio se refere a um conjunto de procedimentos científicos desenvolvidos de forma sistemática com seres humanos com vista a avaliar a ação a segurança e eficácia de medicamentos de produtos de técnicas de procedimento de dispositivos médicos ou de cuidados da saúde para fins terapêuticos preventivos ou de nóstico verificar a distribuição de fatores de risco de doenças ou de agravos na população avaliar os efeitos de fatores ou de estado sobre a saúde os ensaios clínicos também segundo a lei refere-se a pesquisas clínicas experimentais com um ou mais seres humanos
realizadas para avaliar segurança o desempenho Clínico ou a eficácia do dispositivo médico medicamento experimental ou terapia avançada por meio dos ensaios clínicos advenha as investigações cujas descobertas proporcionam inovação científica e tecnológica a pesquisa clínica pode contribuir significativamente para a meta 3.8 dos objetivos do de desenvolvimento sustentável ods da ONU que Visa assegurar o acesso Universal à saúde de qualidade e a medicamentos e vacinas seguras eficazes e acessíveis para todos essa meta está diretamente ligada à ampliação do acesso a cuidado de saúde essenciais medicamentos e Tecnologia de saúde e a pesquisa clínica desempenha um papel fundamental
neste processo a pesquisa clínica é essencial para desenvolvimento e registro de novos medicamentos condição necessária para que novas alternativas terapêuticas sejam introduzidas no mercado portanto são Pilar essencial para a saúde pública gerando evidências para que novas opções terapêuticas possam estar disponíveis paraa população fazendo um recorte no universo da pesquisa clínica para produtos classificados como medicamento dentre eles os produtos biológicos e um recorte mais específico ainda para os ensaios clínicos que visam subsidiar o registro de medicamentos No Brasil temos universo que a norma hora em Pauta abrange e se destina a regulamentar na pesquisa clínica de
medicamentos os ensaios clínicos podem ser basicamente divididos em quatro fases O que representa uma ordem lógica de desenvolvimento onde informações obtidas tem uma fase pode influenciar o delineamento das etapas seguintes as fases de um a quatro esses termos antes muito restritos aos medicamentos científicos aos meios científicos se se popularizou durante a pandemia covid-19 sendo pauto de debates públicos onde a importância da pesquisa clínica e de todo o arcabouo regulatório relacionado ficou evidenciado para a população em geral os ensaios clínicos realizados Total ou parcialmente no Brasil com objetivo de Sub de a o registro de medicamento
precisam ser autorizados pela Anvisa e aprovados pela comissão nacional de ética eem pesquisa ou pelos comitês de ética em pesquisa a Anvisa mantém critérios rigorosos para avaliar e monitorar ensaios clínicos em todas as suas fases antes de aprovar um ensaio a agência realiza uma análise detalhada do protocolo considerando dados pré-clínicos e resultados de estudos clínicos anteriores para aprovação das especialmente das fases subsequentes por exemplo para aprovação de estudos de fase um que são são os primeiros estudos em humanos os dados pré-clínicos são avaliados isso Visa garantir que os que o medicamento investigacional tem um perfil
de segurança adequado antes de ser testado em humanos assegurando que as pesquisas sigam padrões de proteção dos participantes e qualidade científica exigidos pela regulação os ensaios clínicos devem seguir as boas práticas clínicas que estabelecem padrões internacionais para garantir a condução ética e segura da pesquisa com seres humanos as boas práticas assegura a proteção dos participantes e a integridade dos dados garantindo que os ensaios clínicos sejam realizados de forma rigorosa transparente e conforme às normas globais de segurança e qualidade com os avanços das nas tecnologias da saúde e a evolução das necessidades sociais é essencial que
os órgãos como Anvisa adota em abordagem dinâmicas para fortalecer o ecossistema de inovação no Brasil as propostas trazidas para a atualização do atual marco regulatório visam agilizar e tornar mais eficiente o desenvolvimento de novos tratamentos mantendo ao mesmo tempo a proteção à saúde e a qualidade dos ensaios clínicos o que permitirá a integração das inovações com melhores respostas às demandas da sociedade e da economia Nacional a modernização das estratégias regulatórias é essencial para consolidar um ecossistema de inovação robusto no Brasil capaz de atender crescentes necessidades da saúde pública e impulsionar o desenvolvimento tecnológico nessa direção
Anvisa deve atuar de maneira proativa criando o ambiente que favoreça a pesquisa o desenvolvimento de novas tecnologias em saúde isso garantirá que o Brasil esteja alinhado com as melhores práticas globais incentivando a Inovação e permitindo o acesso a tratamentos mais eficientes Seguros a regulação hora proposta reflete o compromisso da amisa em fortalecer o suporte a Inovação no setor de pesquisa clínica no Brasil promovendo um ambiente mais dinâmico e eficiente para o desenvolvimento de novos medicamentos ao revisar o marco regulatório a agência buscou aumentar a celeridade e a segurança dos processos acompanhando as mudanças tecnológicas e
as necessidades do setor essa abordagem Visa facilitar a Inovação enquanto mantém altos padrões de segurança e eficácia paraa saúde pública nessa direção a proposta relacionada às normativas mencionadas a revisão da rc9 de 2015 e a elaboração de instrução normativa complementar visam modernizar o arcabo regulatório de ensaios clínicos no Brasil aliando as melhores práticas internacionais promovendo maior celeridade e eficiência na análise dos processos contribuindo para impulsionar a competitividade do do país no rank global de saúde a nova regulamentação busca atualizar as regras para a condução de ensaios clínicos no Brasil com foco em reduzir entraves burocráticos
e facilitar o desenvolvimento Clínico de medicamentos harmoniza práticas regulatórias Nacionais com padrões internacionais preconizados pelo conselho internacional para harmonização de requisitos técnicos para medicamentos de uso humano i ch destacadamente o guia de boas práticas clínicas e CH E6 a Anvisa Por meio dessa medida regulatória também espera maior atratividade do Brasil para investimentos em pesquisa clínica redução do tempo para o início de estudos clínicos favorecendo o acesso rápido às inovações e o fomento a competitividade da indústria nacional no cenário Global a RDC proposta introduz definições mais precisas para a categoria de risco fase dos estudos e
requisitos técnicos a instrução normativa apresentada no processo propõe critérios Claros paraa classificação dos riscos e a e a complexidade dos ensaios clínicos e dos medicamentos experimentais e a definição de autoridades reguladoras estrangeiras equivalentes visando a análise otimizada de petições a classificação de risco e a complexidade possibilita a distinção entre estudos de baixo e alto risco considerando a intervenção o público alvo e a complexidade do protocolo traz a avaliação do perfil de segurança conhecido do status regulatório do status regulatório internacional do mecanismo de ação do medicamento experimental bem como traz a lista objetiva das autoridades regulatórias
consideradas equivalentes pela Anvisa para fins desse processo regulatório importante pontuar a efetivação da análise otimizada como um procedimento simplificado para ensaios clínicos com medicamentos já avaliados por outras autoridades equivalentes Com redução da duplicidade de análise em caso de aprovação prévia por uma das autoridades equivalentes o processo decisório no Brasil este procedimento é especialmente importante para reduzir os prazos de decisão para estudos multicêntricos que possuem muitas vezes inclusão competitivas de pacientes a otimização e avaliação baseada em risco nas regulamentações discutidas permite que anisa concentre esforço nas inspeções de boas práticas clínicas essenciais para garantir a qualidade
dos ensaios clínicos para tanto o setor deve fomentar o ambiente que cumpra rigorosamente as normas brasileiras alinhadas com as diretrizes do i e da Organização Mundial da Saúde para contribuir com essa perspectiva a copec dir2 publicou seu primeiro relatório anual de mét de inspeções em boas práticas clínicas detalhando nove inspeções realizadas em 2023 destacando a importância desse trabalho no fortalecimento da pesquisa clínica no Brasil na esteira do apoio a Inovação destaca previsão normativa de regulamentação do procedimento regulatório de submissão contínua que é muito relevante paraa agilidade no processo de pesquisa clínica de medicamentos permitindo a
apresentação de dados parciais ao longo do desenvolvimento Clínico antes da submissão definitiva do dossier desenvolvimento Clínico de medicamento ddcm esse procedimento Visa otimizar a análise possibilitando uma avaliação preliminar e o acompanhamento contínuo dos dados o que que pode acelerar a aprovação de novos tratamentos e garantir maior eficiência no processo regulatório esse tipo de procedimento permite acompanhamento regulatório estruturado das inovações as medidas à medida que as provas documentos técnicos e resultados de estudos vão sendo obtidas esses esse procedimento em consonância com aconselhamento regulatório no longo prazo longo prazo reduz os riscos de falhas no desenvolvimento em
decorrência de descumprimento de Norma sanitária também permite que avaliações que são feitas no processo de desenvolvimento como por exemplo dos resultados de fase um para aprovação do protocolo de ensaio fase dois já façam parte administrativamente de um processo que culminará com pedido de registro sem redundância de análise isso aqui é muito importante que já façam parte administrativamente de um processo que culminará em um pedido de registro sem redundancia de avaliações para estabelecer orientações para a submissão contínua na pesquisa clínica será crucial que a Anvisa considere estabelecer os procedimentos e diretrizes que reforcem o alinhamento com
as prioridades de saúde pública e a Inovação Nacional promovendo acessibilidade e benefícios terapêuticos significativos por exemplo nas seguintes situações inovações radicais com potencial para produção nacional e relevância terapêutica para o SUS medicamentos e vacinas destinadas ao enfrentamento de crises sanitárias e emergência de saúde pública vacinas inovadoras de produção nacional e estratégica para o programa nacional de imunizações medicamentos novos resultante desenvolvimento de processos de transferências tecnológicas relevantes para o SUS medicamentos selecionados no programa de de desenvolvimento e inovação local ainda visando otimizar fluxos e análise técnica o procedimento de submissão deve prever como se dará interface
entre a finalização da etapa de pesquisa clínica de responsabilidade da cpec e a etapa de registro de medicamento responsabilidade da gg médi ou ggb para a qual também está sendo proposta nessa decol a regulamentação do processo de submissão contínua a falta do efetivo aproveitamento do do ddcm e das análises relacionadas para fins de registro foi apontado na consulta pública e esse tipo de abordagem iria de encontra a tal ponto esse tipo de abordagem regulatória é essencialmente importante para o desenvolvimento de inovações nacionais onde os estudos desde a as fases iniciais são discutidos com a VISA
o que poderá que poderá acompanhar seu desenvolvimento Dentro de uns ritmo um ritmo regulatório mapeado transparente e mais previsível tanto para o regulado como para o regulador para melhorar o ecossistema de inovação também é essencial que os centros de pesquisa clínica atuem como referências nacionais atendendo padrões internacionais de qualidade isso permitirá que a Anvisa e as autoridades reguladoras de países com sistema robustos utilizem de forma confiável confiável os resultados de ensaios clínicos realizados no Brasil para subsidiar o registro de novos medicamentos essa abordagem fortalece a credibilidade e a competitividade do país no cenário Global ampliando
sua capacidade de atrair investimentos e consolidar o papel estratégico da pesquisa clínica na inovação e saúde Neste contexto as organizações representativas da pesquisa clínicas a rpcs que desempenh um papel fundamental Ao serem contratadas pelos patrocinadores de estudos para executar alguma ou todas as as as funções relacionadas à condução de pesquisa clínica ganha um destaque por sua capacidade de contribuir para que os estudos atendam aos rigorosos padrões regulatórios promovendo a proteção dos participantes e assegurando a conformidade ética ao alinhar as práticas nacionais as diretrizes internacionais as orpc contribu contribuem significativamente para a credibilidade e eficiência do
ecossistema de pesquisa clínica no Brasil para o sucesso do marco regulatório proposto é indispensável é indispensável o comprometimento dos patrocinadores dos ensaios clínicos do centro de pesquisa clínica e de todos os envolvidos no controle e na garantia das conformidades a a responsabilização do setor emerge como um dos pilares fundamentais desse Marco especialmente diante de prazos estreitos essa abordagem busca assegurar que todos os atores envolvidos atuem de forma coordenada e ética contribuindo para a eficiência segurança e credibilidade dos ensaios clínicos realizados no Brasil nesta linha destaca o comprometimento a qualificação e excelência dos especialistas da Anvisa
na regulamentação de pesquisa clínica Nacional Tais atributos são evidenciados pela titulação de auditores da Organização Mundial da Saúde para pesquisa clínica atribuída a servidores como a especialista em regulação e Vigilância Sanitária Adriane Alves de Oliveira lotada na coordenação de pesquisa clínica essa titulação reforça o compromisso da agência em adotar as melhores práticas internacionais e em garantir integridade dos ensaios clínicos conduzidos no Brasil contribuindo para o fortalecimento do ecosistema regulatório e científico Nacional voltando ao texto da regulamentação a RDC proposta especialmente destaca a redação dado artigo 91 que além da previsão de regulamentação do procedimento de
submissão contínua prever a edição de normas guias ou manuais com orientações complementares para o cumprimento da resolução como procedimento que permita Dar maior celeridade às análises de petições primária e secundária de desenvolvimento Clínico sem prejuízos as regras de priorização de análise estabelecidas em regulamentos e sem comprometer a segurança dos participantes dos ensaios clínicos quando se trata de desenvolvimento de inovações ter certa da flexibilidade no processo regulatório permite que se dê o devido tratamento sanitário aos casos concretos sem comprometer a segurança dos participantes de ensaios clínicos a Inovação por si só remete a algo inédito que
o arcabouço regulatório já posto pode não se amoldar de forma adequada dispor de medidas complementares normativas e não normativas visando a orientação dos desenvolvedores e direcionamento das análises técnicas pode apoiar a celeridade e a eficiência das análises de petições de desenvolvimento Clínico sem prejudicar a segurança de ritos administrativos processuais dentro as medidas complementares previstas chama atenção para a previsão no artigo 29 de edição de ato normativo complementar referente a requisitos de qualidade do insumo farmacêutico ativo ou substâncias ativas e do produto sobre investigação considerando sua complexidade tecnológica o que pode incluir diretrizes detalhadas considerando as
boas práticas de fabricação dados parciais de estabilidade e outros aspectos essenciais a medida ajudará a Anvisa a definir claramente como os dados de tecnologia farmacêutica qualidade como de estabilidade devem ser apresentado ao longo do desenvolvimento enquanto manté os altos padrões de segurança e eficácia exigidos para cada tipo de medicamento isso permitirá maior flexibilidade e rapidez nas avaliações sem comprometer a qualidade para essa evolução recomendo envolver a câmara técnica de pesquisa clínica recentemente e eu queria fazer um agradecimento especial ao diretor Daniel pelo apoio na publicação da câmara técnica de pesquisa clínica que tem objetivo de
apoiar a pesquisa clínica no país não só paraa área de medicamentos mas pra área de produtos e a gente lembrar Especialmente quando a gente fala em pesquisa clínica a regulamentação não pode ser estática mas também envolver as universidades empresas fabricantes Startup no processo de discussão e a definição das diretrizes regulatórias entendo que tal iniciativa é fundamental para criar um ambiente mais inclusivo e eficiente para o desenvolvimento de medicamentos essa colaboração garantirá que a regulamentação atenda a diversidade de produtos e estágio de desenvolvimento Clínico ao mesmo tempo em que se preserva a segurança e a qualidade
dos ensaios clínicos por derradeiro reafirmo que a proposta de nova regulamentação em conformidade com as determinações legais está alinhada a agenda de inovação e o fortalecimento Nacional essas atualizações reforçam o compromisso da agência em fomentar um ecossistema de pesquisa e desenvolvimento buscando um avanço contínuo na produção nacional e inovação do setor saúde enquanto garante segurança jurídica e ética nos ensaios clínicos por fim o momento atual é de inflexão para a saúde Global onde o aprendizado da pandemia e o uso de dados novas tecnologias Inteligência Artificial e medicamentos de precisão indica o início de uma transformação
profunda nos tratamentos médicos assim a Anvisa tem a oportunidade de capitalizar esses aprendizados para fortalecer ainda mais o ecossistema de pesquisa clínica no Brasil contribuindo para o fortalecimento do país como a importante Polo de inovação e desenvolvimento de novas terapias Diante do exposto e considerando a a conclusão do longo trabalho de avaliação de impacto regulatório de consulta pública com base em práticas de rilis convergência regulatória simplificação normativa e aderências às ferramentas GBT da Organização Mundial da Saúde além do novo Marco legal a lei 1487 4 de 2023 para pesquisa clínica concluo que o processo conduzido
pela copec possui robustez e maturidade portanto voto pela aprovação da resolução da diretoria colegiada para disor sobre as diretrizes e os procedimentos para a realização de ensaios clínicos no país visando a posterior concessão de registro de medicamentos e da instrução normativa que estabelece a lista de autoridades reguladoras estrangeiras equivalentes e detalha os critérios para adoção de procedimento otimizado de análise por ulise e por avaliação de risco e complexidade de petições de ddcm deec modificações substanciais ao produto sobre investigação e emendas substanciais ao protocolo clínico aponto que nos próximos meses a copec precisa priorizar a elaboração
de guias orientações ou novas instruções normativa para contribuir com o avanço do ambiente regulatório com ênfase na subão contínua e no dossiê de qualidade de medicamento experimental ressalto ainda a importância de debater e considerar as inspeções de boas práticas de fabricação na planta de fabricação desses medicamentos realizados pela Anvisa ou visas tal abordagem fortalecerá ecossistema regulatório Nacional garantindo que as práticas brasileiras estejam alinhadas aos padrões internacionais como osos adotados por países da Comunidade Europeia além de incentivar a produção local de medicamentos experimentais de qualidade chamo atenção especialmente do ponto de vista da importação dos insumos
a ser utilizado na pesquisa clínica como um grande avanço para redução de sistema contudo dentro desse monitoramento pode haver necessidade especialmente de um trabalho mais próximo entre a copec especialmente a ggp e a ggts porque os insumos que podem ser necessários precisam precisarão também ser internalizados na mesma velocidade do que o medicamento experimental certamente isso contribuirá para melhor previsibilidade organização da dos ensaios clínicos mas também levará a maior responsabilização dos patrocinadores finalizo agradecendo e para e para parabenizo a equipe de servidores da Anvisa especialmente ao grupo responsável pela elaboração e atualização das regulamentações cujo trabalho
é essencial para garantir a segurança e inovação do setor de pesquisa clínica o esforço contínuo da equipe contribui para o fortalecimento do sistema de saúde e para o avanço da ciência no Brasil posicionando o país como líder na área Parabéns Cláudia osvan aqui Cláudia osvan Martins Alves de Souza não tem homonímia navisa como eu pelo excelente trabalho e contribuição Avisa sua dedicação tem sido fundamental para o avanço das regulamentações e para o fortalecimento do sistema de saúde no Brasil a equipe da Anvisa sob sua orientação tem feito um trabalho excepcional para garantir a segurança inovação
e eficácia nos processos de pesquisa clínica e no desenvolvimento de novas soluções para saúde pública sendo este voto que submeto a matéria para a deliberação dessa douta diretoria colegiada e agradeço pela honra de ter relatado essa matéria Obrigado diretora meiruze coloco o tema em discussão eem votação com o diretor Daniel Pereira Obrigado Presidente cumprimento a diretora pelo voto trazido sendo bem breve cumprimento também em nome do Cláudio do Cláudio jvan toda a equipe da copec toda a equipe da da área de pesquisa clínica mais uma ação diretora né de fortalecimento da pesquisa clínica no Brasil
e sigo na íntegra voto da relatoria Obrigado diretor Daniel também cumprimento aqueles que fizeram manifestação oral nessa Diretoria colegiada O Senor Tiago Moraes da PR genérico a senhora Luciana tacara é da interfarma Agradeço também Dr Claudio osvan pela apresentação técnica realizada e toda a equipe também que deu sustentação a essa diretoria colegiada para deliberação desse importante tema na data de hoje eu também declaro Que acompanho o voto da diretora relatora fica aprovado por unanimidade o item 2.8 da pauta peço só pros senhores eh avaliarem eh que se a gente continua deliberação do próximo item porque
a gente tem uma uma necessidade de no máximo às 15 horas suspender eh esse colegiado por outros compromissos oficiais que temos temos ainda alguns itens cinco itens cinco itens a serem deliberados ainda continuamos vamos podemos 5 minutos pelo menos Podemos sim então a gente vai suspender por 5 minutos e retornaremos em 10 minutos obrigado Boa tarde retomamos a 23ª reunião ordinária pública da diretoria colegiada passo imediatamente a palavra ao diretor Presidente substituto drom obrigado senhora secretária geral próximo item ser deliberado eh pela sequência aqui dos itens de pauta é o item 2.9 no entanto faço
uma questão de ordem consulta os diretores sobre uma solicitação de inversão de pauta para que possamos deliberar agora de imediato o item 2.10 por uma questão de termos que cumpriu no cronograma ajustado com o Tribunal de Contas e solicito essa inversão de pauta para que possamos deliberar de imediato item 2.10 coloco essa questão em votação diretor Daniel de acordo Presidente Obrigado diretor diretora merus Freitas também acompan obrigado diretora meus passo a palavra secretária geral obgada Obrigada Dr romon chamo então o item 2.10 relatório de análise de impacto regulatório e proposta de consulta pública de resolução
da diretoria colegiada para dispor sobre as diretrizes a serem observadas nos processos sanitários instaurados pela Anvisa relatoria do diretor Dr rson Motta que está com a palavra obrigado senhora secretária geral é o voto 2009 de 2024 da quarta diretoria ara Responsável a cagis a coordenação de autuação administrativa e julgamento das infrações sanitárias é um tema da agenda regulatória 2024/2025 é o tema 1.4 que é a definição de procedimentos para o julgamento de processos administrativos sanitários Passa ao relatório trata-se de análise de propostas apresentada pela cagis relacionadas à aprovação do relatório de análise de impacto regulatório
que tá no documento se 30426 realização de consulta pública para recebimento de contribuições a minuta de RDC que dispõe sobre as diretrizes assim observadas nos processos administrativos sancionatórios pas no âmbito da Anvisa a proposta esteve inicialmente na agenda regulatória de 2017/2020 e atualmente consta na agenda regulatória 2024/2025 Como já citado por mim a abertura do processo regulatório se deu por meio do termo de abertura do processo número 134 em 11/12 de2020 tendo como principal motivação o acórdão 732 de2020 exarado pelo tribunal de contas da União que após a auditoria de processos em curso na Anvisa
concluiu que o PAS na agência é ineficiente na apuração das infrações sanitárias e na sua responsabilização nesse bojo foram considerados como ações necessárias à resolução do problema um instituir uma unidade responsável pela gestão do p abarcando a instrução autuação julgamento e recursos independentemente do objeto de forma a conferir uniformidade e segurança jurídico ao processo dois normatizar o p de forma sistêmica três estabelecer sistema informatizado para completa gestão e tramitação do Pas de forma totalmente eletrônica quatro avaliar a possibilidade de edição de boletim interno de jurisprudência com divulgação periódica na rede interna da agência de forma
a contribuir a contribuir para uniformidade de entendimentos cinco avaliar a possibilidade de disponibilizar informações consolidadas em Sítio Eletrônico em formato bi com informações mínimas seis normatizar a utilização do termo de ajustamento de Conduta para pas 7ete encaminhar a Casa Civil para análise posterior envio ao congresso nacional proposta de alteração da lei 6437 de 1977 conforme minuta já elaborada no âmbito da Anvisa e adicionando se for o caso os aspectos retratados no relatório do referido acórdão considerando Tais determinações a Anvisa vem atuando em diversas frentes com vistas a melhoria do processo de trabalho de fiscalização desde
a concepção do dossiê de investigação até o julgamento do pasas e aplicação de sanções quando for o caso a construção da proposta de minuta de RDC a ser submetida à consulta pública é uma dessas ações e tem por objeto dar transparência e segurança jurídica ao processo inicialmente foram realizadas oficinas de trabalho conduzidas pela coordenação de acionamento em análise de impacto regulatório para subsidiar o processo de elaboração do relatório de análise do de impacto regulatório considerando a a transversalidade da matéria diversas unidades organizacionais da agência participaram das discussões a saber a GG fis a copais a
GG paaf a cmpf a cagis a gerência Geral de recursos e a segunda coordenação de recursos especializada durante as oficinas as etapas subsequentes eh foram definidas eh durante as oficinas e etapas subsequentes foram definidos os problemas regulatórios relacionados suas causas raízes e os Agentes afetados a fim de delinear a proposição de requisitos os principais problemas regulatórios segundo esse trabalho correspondem a demora no alcance dos resultados esperados e os curos processuais de imagem da Anvisa que podem ser maiores que os eventuais benefícios assim Foi estabelecido o objetivo geral de tornar o p nvis eficiente e eficaz
já dentre os objetivos específicos priorizou-se a construção do instrumento regulatório sobre os procedimentos relacionados ao pasas eh o objetivo geral e específico se encontram alinhados ao objetivo estratégico um do plano estratégico da anva 2024 2027 de viabilizar o acesso seguro a produtos e serviços essenciais para a saúde da população o relatório de a concluiu que as alternativas propostas são viáveis e Podem trazer benefícios significativos para a gestão do P nava nesse aspecto passa-se a tratar da proposta regulatória a qual se propõe que seja submetida à consulta pública passaria à análise o processo administrativo sancionatório pas
representa importante instrumento para o exercício da função desempenhada pela vigilância sanitária na proteção da Saúde sendo utilizado pela administração pública com finalidade de apurar as irregularidades sanitárias detectadas e as responsabil cidados do infrator assegurando a Ele o direito de ampla defesa e contraditório de modo a respaldar com juridicidade a aplicação da penalidade correspondente que lhe for imputada a lei 6437 de 20 de agosto de 77 que trata das infrações sanitárias e a Lei 9784 de 1999 que dispõe sobre a organização formal dos procedimentos são os principais diplomas legais que regem o PAS além delas cita-se
a legislação que ao tratar da autuação e do julgamento das infrações sanitárias complementam a a base legal específica a lei 9294 de 96 que aborda a restrição ao uso e a propaganda de produtos fumígenos fumígenos bebidas alcoólicas medicamentos terapias e defensivos agrícolas nos termos do artigo eh pargrafo 4 do artigo 220 da Constituição Federal e a Lei 9873 de 19 99 que dispõe sobre o prazo de prescrição para o exercício de ação punitiva pela administração pública federal cita-se ainda a RDC Anvisa 266 de19 que estabelece os procedimentos relativos à interposição de recursos administrativos em Face
das decisões da Anvisa e da outras providências rdcs que encontra ainda em revisão cuja relatoria do diretor Daniel Pereira complemento as instruções para adequada condução dessa atividade os pareceres emitidos idos pelela procurad pela procuradoria federal junta Anvisa e orientações de serviços que auxiliam no entendimento e interpretação normativa promovendo a harmonização das atividades relacionadas ao pasas as quais são realizadas por diferentes unidades organizacionais no âmbito da Anvisa feita essa contextualização conforme já mencionado em 2019 as atividades que envolvem o p foram auditadas pelo tribunal de contas da União que concluiu pela ineficiência do processo de apuração
e responsabilização das infrações sanitárias no âmbito da Anvisa em síntese o acordo 7 o acordo 732 de 2020 apontou a baixa celeridade processual haja visto o tempo médio entre a autuação e o trânsito em julgado ser superior a 5 anos também destacou o baixo índice de punição efetiva aos infratores sanitários tendo em vista o baixo índice de pagamento das multas entre 2015 e 2019 apenas 45% das multas transitadas em julgados foram pagas outro relevante aspecto trazido pelo TCU Corresponde à necessidade de adoção de ferramentas de Gestão de Risco no pasas com vistas à utilização de
fatores de relevância relevância e materialidade para a escolha da atuação da atuação sendo observado que as infrações identificadas no âmbito da agência são em sua maioria consideradas leves com risco sanitário baixo de fato é patente a existência de fragilidades que impactam diretamente na efetividade do processo de fiscalização sanitária os longos períodos para lavratura de um auto de infração sanitária a partir da identificação da infração as eventuais falhas na instrução processual a necessidade de harmonização no estabelecimento de penalizações e os tempos observados até que se tenha o julgamento do pasas favorecem as prescrições os eitos buscados
nos processos resultando em percepção da impunidade em relação ao descumprimento dos normativos sanitários parte disso se deve à necessidade de reorganização dos processos de trabalho e de sua informatização Até recentemente os autos de infração sanitária ainda eram instruídos em processos físicos que recentemente passaram a ser digitalizados e transferidos para o sistema sei para continuidade da a tramitação apenas por esse fato nota-se que há muito a evoluir desse modo resta claro que é imprescindível que se se avalia o esforço empregado pela Anvisa em sua atuação que pressupõe o gasto de milhares de hor de horas de
trabalho a um custo elevado em prejuízo de outras atividades ao longo da auditoria realizada pelo TCU foi constatada a defasagem da lei 6437 de 1975 S que abre um parêntese para dizer que essa agência já encaminhou aos órgãos do executivo competente uma proposta eh para alteração da lei 6437 19977 continuando que representa um obstáculo para eficiência do pasas dentre os obstáculos cita-se a ausência de previsão de priorização de tratamento das infrações com risco sanitário classificado como médio Alto dos valores médios das multas de pasadas e a importância de se prever a possibilidade de notificação do
do autuado por meio eletrônico Considerando o intervalo decorrido desde a publicação da referida lei é natural que os dispositivos legais não contemplem as mudanças no comportamento do mercado e a evolução tecnológica observad desde a sua edição esse cenário permite concluir que o pasas navisa apresenta limitações que comprometem a sua eficiência com a elaboração do relatório de análise de impacto regulatório constatou-se que os problemas regulatórios a serem enfrentados são diversos e se iniciam pela insuficiência do acabolso legal para abarcar diversas situações considerando a realidade sanitária atual soma-se aos pontos levantados a necessidade de descrição mais objetiva
dos critérios para a configuração da gravidade da infração como leve grave ou gravíssima bem como das atenuantes e agravantes esse é o problema regulatório que a proposição hora em discussão pretende abordar nesse sentido almeja-se ainda que a submissão da proposta à consulta pública possa trazer contribuições à sociedade que permitam tornar o processo mais consistente de forma a cumprir com o objetivo a que se propõe conforme já relatado durante o exercício das atividades exigidas na condução do pasas é comum Que dúvidas de natureza de veram sejam suscitadas sendo corriqueira a realização de consultas à nossa procuradoria
federal que se que manifesta seus entendimentos por meio de pareceres consultivos muito desses entendimentos já estão consolidado entre as unidades afetas ao paas por essa razão buscou-se transpor esses entendimentos legais consolidados na proposta normativa de modo a promover a transparência e segurança jurídica ao regulado assim a redação buscou contemplar entendimento do órgão jurídico da Anvisa acerca de temas como a dupla visita a consideração dos antecedentes do infrator e aplicação das circunstâncias atenuantes e agravantes a proposição busca estabelecer conceitos necessários à condução do pasas indicando suas etapas administrativas desde a lavratura do alto de infração sanitária
até a certificação do trânsito em julgado por se tratar de tema transversal a muitas áreas atuantes a proposta embora apresentada pela coordenação de atuação administrativa e julgamento das infrações contou com as contribuições das seguintes áreas organizacionais afetas a copaz a cmpf a gegar a cres 2 a gedoc a ggp a GG paaf a GG Tab a ggx e naturalmente a GG fis outro destaque é a ent ação da aplicação da penalidade de multa sessão 4 do capítulo 2º inclusive para autuados estrangeiros que tá no Artigo 49 da proposta hipótese que carecia de previsão regulamentar Foram
ainda estabelecidos critérios objetivos para a fixação do valor da multa à luz do princípio da Equidade de modo a parametrizar os limites estabelecidos pela lei salienta-se que a proposta também moderniza o PAS quanto à inclusão de dispositivos que trazem mais celeridade para a comunicação dos atos do processo além da previsão de celebração de termo de compromisso de ajustamento de Conduta o tcac o tcac é um instrumento já utilizado em outras agências reguladoras que tem por objetivo adequar reparar ou compensar conduta considerada irregular às disposições legais regulamentares e sanar e cessar os efeitos da infração imputada
a publica a da lei 14671 de 2023 que alterou a 6437 de 77 permitiu a utilização deste importante instrumento das ações de fiscalização sanitária o qual tem um condão de simplificar o rito processual principalmente em situações em que reste demonstrado o baixo risco sanitário da infração e a demonstração Clara de vontade aliada é de vontade aliada a disponibilidade de recursos por parte do infrator de os possíveis impactos causados e retornar à conduta eh regular de forma imediata eh criamos um GT que já vinha se debatendo o assunto desde fevereiro de 2024 passou a se reunir
semanal ou quinzenalmente durante 4 meses que se seguiram a sua instituição nessas reuniões foram levantadas as necessidades e realidades das diferentes áreas de atuação da Anvisa com enfoque nas diferentes situações e benefícios que poderiam Advir da celebração de termos de compromisso mediante a identificação das infrações sanitárias com destaque para a redução da Mora administrativa e rápido retorno do infrator à condição de regularidade com cessação imediata do risco a possibilidade de celebração de um termo de compromisso tem o condão de fomentar a relação de colaboração entre o agente regulador e o ente regulado com vistas ao
benefício coletivo ademais trata--se de instrumento que apresenta potencial resolutivo significativo considerando sua adequação para tratar de situações específicas conforme interesse da administração que não pode estar dissociado do interesse da saúde pública não obstante por se tratar de ferramenta inovadora no cenário da regulação sanitária não é possível mensurar os efeitos decorrentes da permissão ou eventual incentivo ao seu requerimento por essa razão entende-se que a instituição do termo de compromisso na Anvisa com o objetivo de solucionar situações de flagrante descumprimento do regramento sanitário deve estar associada à elaboração de critérios consistentes no que se refere ao benefício
risco decorrente de sua eventual celebração ademais vislumbra-se que devem ser ponderados os efeitos relacionados à carga administrativa adicional para as unidades afetas ao processo por esse motivo o melhor por esses motivos sugere-se que os termos de compromisso de que trata o artigo 28 A da Lei 6437 sejam em princípio celebrados de ofício quando identificada que sua celebração apresenta relação benefício risco favorável à saúde pública por fim destaque-se o anexo um da proposta que apresenta a tabela de multas considerada a capacidade econômica do infrator conforme o porte Está no artigo 2º e terceiro da alemia 437
a natureza da inflação da infração leve grave e gravíssima nos termos do artigo 2º pargrafo primiro da mesma Lei e a gradação do Risco sanitário Baixo médio e alto sob o fundamento do artigo 6 sego do mesmo diploma legal os valores orora apresentados trazem transparência para as autoridades sanitárias e para os autuados o que poderá reduzir a rediscussão os parâmetros utilizados para a fixação dos valores da multa em sede recursal ressalto ainda que a proposta em apreciação é parte de um conjunto de iniciativas de melhorias e otimização do processo administrativo sanitário sancionatório na Anvisa a
presente resolução da diretoria colegiada inaugura uma nova etapa de ação da agência em proteger a saúde da população por meio de seu dever legal de de autuar e aplicar as pen previstas em lei cabe ressaltar uma vez mais que a proposta decorrente de recomend que a proposta decorre de recomendação do Tribunal de Contas da União disposta no item 9.2.2 do acó 732 de 2020 desse modo a presente iniciativa regulatória além de observar as recomendações do órgão de Controle externo assenta os entendimentos jurídicos consolidados promove a segurança jurídica do PS eh regulamenta as lacunas legais e
fomenta a celeridade e eficiência e a função pedagógica do dever punitivo nesse sentido a Anvisa ao promover a elaboração de um regramento de tal natureza reafirma seu compromisso com a gestão eficiente com a transparência e com a responsabilidade institucional conferida por sua lei por de de sua criação passando ao voto eh digo que o o o aí íntegro do voto é publicidade que eu fez alguns pers saltos aqui no voto mas eu queria agradecer também todos os servidores da Anvisa que tem ombrado eh A Diretoria da agência na condução desse processo eh que é um
processo que transversal que mexe com muitas muitas áreas da Anvisa com muito processo de trabalho e não é fácil harmonizar os entendimentos Então esse realmente é um eh um Primeiro passo é essa consulta pública para que a gente possa dar oportunidade para para e a sociedad os interessados se manifestarem e de forma A enriquecer essa proposta que posteriormente será deliberado pelo colegiado do voto em face do exposto considerando que a proposta em discussão Visa regulamentar o processo administrativo sanitário sancionatório no âmbito da Anvisa suprir lacunas da legislação vigente e atender as recomendações do Tribunal de
Contas da União voto pela aprovação do relatório de análise de impacto regulatório e de realização de consulta pública pelo período de 45 dias para a coleta de contribuições sobre a proposta normativa que Visa dispor sobre as diretrizes a serem observada nos processos administrativos sanitários sancionatórios no âmbito da Anvisa é o voto que submeto a este colegiado coloco em discussão votação e considerações diretor Daniel Pereira Obrigado Presidente eh gostaria de parabenizar pelo voto detalhado e pela proposta trazida à discussão da mesa de fato é uma proposta de grande complexidade des desde o início da discussão do
air e fico muito feliz no resultado que conseguimos chegar para disponibilizar a consulta de toda a sociedade eh gostaria também de fazer alguns apontamentos especialmente a proposta né destacar a questão da eficiência do processo que é trazida e em especial da possibilidade da notificação eletrônica bem alinhada as mais as melhores práticas em relação a esse tipo de processo em nas demais agências no próprio sistema contencioso do Poder Judiciário eh destacar também a regulamentação do termo de compromisso aqui uma regulamentação mais precisa né Desse importante instrumento até conferido aqui a Anvisa destacar a tabela de gradação
de multas que vem também adequando de forma mais mais segura em relação ao porte das empresas entre as diversas melhorias queria fazer também mais dois apontamentos diretor em relação é um em relação a GG paaf eh destacar que o desde o começo dessa discussão o relatório de análise de impacto regulatório ele se referia a procedimentos relativos à autuação notificação e julgamento de infrações sanitárias obviamente isso perpassa por várias áreas da casa né inclusive uma das possibilidades uma das alternativas ratórias sugeridas foi a possibilidade de adoção de medidas cautelares e preventivas no caso de algumas infrações
alternativamente a lavratura do auto de infração sanitária e da instauração do pasas essa matéria é é uma matéria de suma importância para GPF especialmente para trazer mais eficiência à fiscalização dos nossos servidores na área de pós aeropost e fronteiras e e o texto apresentado ele ele ele numa numa breve leitura ele não traz um regramento eh eh mais preciso mas eu eu peço que a consideração dessa relatoria que durante né o diretor sorteado que durante o a consulta pública a gente Aproveite essa fase de debate né para trazer eh esse importante discussão de de outras
formas da gente atuar ao invés de uma lavratura de um auto de infração no estação de um processo né a gente tem um sistema de cautelares aqui muito bem definida que pode ser utilizado cada vez trazendo mais mais eh robustez na nossa atuação especial pros servidores que estão na ponta nas áreas de pós aops e fronteiras então fica essa primeira consideração a segunda e eu possuo também um assunto sobre minha relatoria que é a proposta Norma de recursos né que envolvem todos os processos da casa inclusive os processos administrativos eh sanitários né E então também
eu acho que fica aqui a nossa a minha sugestão da gente alinhar durante a consulta público durante as discussões com o setor pra gente chegar em uma proposta só né que a gente consiga convergir e e que a regra de de recursos dos P também seja eh espelhada na regra de recurso da agência que aqui fica o meu compromisso aqui da gente num alinhamento único também trazer a matéria nesse mesmo sentido pra gente aproveitar também a eficiência desses processos como todos no mais Presidente eu eu eh destaco novamente o o o a energia e e
a qualidade do trabalho que foi dada por toda a equipe envolvida aqui no processo eh destaco também a importância de trazer esse tema quanto antes paraa nossa discussão e para que a gente possa colher cada vez mais eh contribuições da sociedade parabenizo todas as árias envolvidas e sigo na íntegra relatoria Obrigado diretor Daniel agradeço imensamente as contribuições acolho a suas duas recomendações para fazer constar que se a matéria sendo sendo aprovada o diretor relator sorteado Observe essas duas recomendações em nome da da celeridade né e da agilidade nesses outros processos que que estão também em
andamento na casa passo a palavra à diretora meru Freitas para discussão e votação Obrigada Presidente eh realmente o processo administração administrativo sanitário que tem a finalidade de sanção dentro desse espírito que nós temos favorecer o acesso e não só a produtos e mas a serviços e estabelecer diretrizes Clara eh ele busca ser a exceção do nosso ato que a gente tem que contribuir e trabalhar cada vez mais para um mercado mais regulado e que atenda as diretrizes sanitárias né então o papel também quando todasas vezes que fala da regulação responsiva o setor tem um papel
fundamental no cumprimento das regras de buscar esses atendimentos inclusive e de nos ajudar no sentido de melhorar as condições administrativas pra agência eh já com recursos humanos tão estreitos então se eu tenho um setor da diversidade que nós temos que nós regulamos cumprindo entendendo as regras sanitárias de forma Clara transparente ganhamos nós a efetividade ganha o país no no pro mercado mais controlado do ponto de vista da saúde que é a nossa finalidade grande parte do nosso trabalho e com isso também nos permite debruçar e ter eh quando necessário ter processos sanatórios mais eficientes e
que não passe aí por longos períodos paraa efetividade da da atuação sanitária quando ela precisa ser fiscalizatória quando o poder de polícia precisa ser exercido eh isso vem vem ao encontro também da proteção a atuação célere com com o poder de polícia não só no ponto de vista cautelar Mas também de finalizar o processo administrativo sanitário de forma mais ágil mais transparente eh e Isso demonstra a maturidade da Anvisa que inclusive nesse processo coloca em consulta pública que são atos administrativos do nosso trabalho então isso Isso demonstra também uma maturidade da agência em buscar outra
outras contribuições e trabalhar com com segurança jurídica com transparência eh por vezes inclusive as auditorias elas indicam eh oportunidad de melhoria contínua e eu reporto isso também nós não estamos só atendendo uma decisão uma recomendação do TCU a gente tá avaliando que a a recomendação trazida pelo tribunal de contas da União num num processo super que supervisionar as agências que faz parte também desse controle legal eh identificar que as auditorias são sempre também oportunidades de melhoria mesmo com essas dificuldades que nós temos de recurso humano mas sempre essa união de esforços para que a gente
alcance esse lugar fazendo um destaque aqui inclusive do Papel dessa liderança considerando também a participação de outros atores referenciando também eh setores como a própria procuradoria a auditoria junto a aviso a própria corregedoria as demais áreas eh e hoje mesmo eu trouxe aqui a questão da própria Norma de pesquisa clínica Tomara que a gente nunca precise fazer um pas para um centro de pesquisa né então a gente precisa trabalhar com isso de forma mais mais uniforme mais rápida e melhorando a eficiência da agência em mais esse ponto dito isso eu cumprimento mais uma vez parabenizo
e volto integralmente com a relatoria Obrigado diretora meiruze portanto fica aprovado por unanimidade o item 2.10 da pauta com o prazo de 45 dias para manifestaçõ da sociedade e em breve senhores diretores espero não receberem mais o meu Zap a cada decol informando que o processo que estamos julgando já passou 9 anos 10 anos 12 anos 14 anos senhora secretária Geral passemos ao sorteio da relatoria da matéria Dr Antônio barra sorteado bom em razão de outros compromissos oficiais eh diante do não exaurimento da paa da presente reunião eu proponho aos diretores a suspensão da presente
reunião com a continuidade dela no próximo dia 11 de dezembro às 9 horas conforme a previsão no artigo do artigo 19 do regimento interno da Anvisa coloco em votação diretor Daniel Pereira de acordo Presidente Obrigado diretora meiru Freitas de acordo M Obrigado diretora e portanto ficou aprovado por unanimidade a suspensão da reunião então nada mais havendo a tratar às 13:34 fica suspensa a sessão e a reunião a 23ª reunião ordinária pública da Diretoria colegiada da anvis Agradeço a todos os participantes inclusive os mais de 100 que nos acompanham nesse momento pelo YouTube obrigado
Related Videos

3:39:14
21ª Reunião Ordinária Pública da Dicol
Agência Nacional de Vigilância Sanitária
1,957 views

6:22:30
22ª Reunião Ordinária Pública da Dicol
Agência Nacional de Vigilância Sanitária
1,821 views

3:16
Eventos adversos e como notificá los
Agência Nacional de Vigilância Sanitária
91 views

3:11
Principais Medidas de Prevenção de Infecçã...
Agência Nacional de Vigilância Sanitária
37 views

48:23
Servidores, autoescolas e instrutores são ...
TVCidadeVerde
2,534 views
3:53
Principais Medidas de Prevenção de Infecçã...
Agência Nacional de Vigilância Sanitária
84 views

36:12
Presidente do Senado e ministro da Fazenda...
TV Senado
1,328 views

12:20
"A situação é extremamente grave, as acusa...
Record News
398,133 views

10:50
💣Bolsonaro confessa crimes em coletiva de...
Mídia NINJA
365,045 views

3:56
Marcel Ciolacu, reacție după decizia CCR d...
Antena 3 CNN
31,841 views

3:34
Câți bani au primit influencerii care l-au...
Știrile ProTV
11,867 views

0:31
Românii pot călători în SUA fără vize, din...
Știrile ProTV
1,099 views

1:30
Călin Georgescu: A venit vremea să ne refa...
RFI România
49,252 views
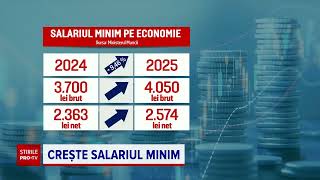
0:25
Salariul minim brut crește la 4.050 de lei...
Știrile ProTV
548 views

2:21
Cod galben de ninsori în 11 județe
Antena 3 CNN
8,676 views
3:51
Ilie Bolojan a prezentat „măsurile de refo...
Antena 3 CNN
2,561 views

8:17
🔥Indiciado, Ramagem aparece na câmara par...
Mídia NINJA
171,008 views

15:00
OABs, Senador Mourão e até Min.Fux alertam...
Alexandre Garcia
518,643 views

5:46
CCR, aproape de a produce un cutremur poli...
Observator News
3,506 views

7:09
Pronunciamento completo feito pelo ministr...
Canal da Resistência
1,017 views