Episódio 10 - Superando Obstáculos! (Energia de Ativação/Lei de Arrhenius)
31.87k views2179 WordsCopy TextShare
Universidade da Química
Neste vídeo eu mostro como podemos determinar a Energia de Ativação de uma reação através da Lei de ...
Video Transcript:
[Música] Olá pessoal sejam muito bem-vindos a mais um vídeo da Universidade da química e o Episódio de hoje tem por tema superando obstáculos que obstáculos são esses o obstáculo que eu me refiro é a energia de ativação é o obstáculo necessário que os reagentes têm de superar para que a reação ocorra o conceito de energia de reação é conhecido por vocês desde o ensino médio nós podemos definir como sendo a energia mínima necessária para que uma reação ocorra e só para nós ilustrarmos vamos imaginar essa reação O dióxido de nitrogênio reagindo com o monóxido de
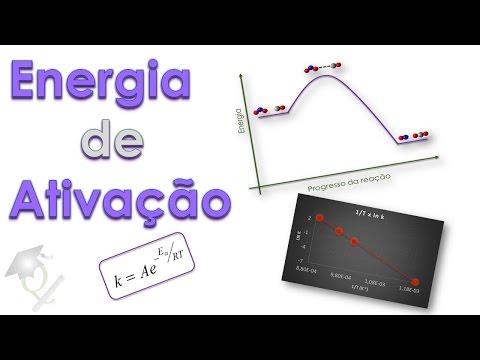
carbono formando o óxido nítrico e o gás carbônico Vamos colocar esses reagentes esses produtos em um gráfico de energia uma espécie de um gráfico termodinâmico onde no meu eixo Y eu tenho a energia necessária para o processo e no eixo X o progresso da reação o caminho da reação inicialmente eu tenho aqui um nível determinado de energia representando os reagentes então aqui eu teri a mistura NO2 e co representado por esse modelo aqui de esferas as esferas vermelhas são os átomos de oxigênio Azul nitrogênio e a cinza o carbono do outro lado no caso dos
produtos eu terei o no e o CO2 também representado aqui por suas esferas e notem que o nível de energia do produto é menor do que o nível de energia dos reagentes portanto é uma reação que nós classificamos como sendo exotérmica nesse caso específico a diferença de energia entre os produtos e os reagentes é de 226 kj é negativo porque ao longo do processo da reação são liberados 226 kj no entanto para que o NO2 reaja com co é necessário ele superar o obstáculo que nós falamos é necessário que ele rompa que ele supere a
chamada energia de ativação mesmo liberando essa quantidade de energia eu preciso fornecer a energia necessária ou energia mínima para que o NO2 comece a reagir com o co eu preciso superar esse morrinho nessa quantidade de energia para que a reação com S E é isso que nós chamamos de energia de ativação nesse caso nesse ponto mais alto nós temos a formação do chamado estado de transição ou complexo ativado o que que é esse estado de transição é o meio termo entre os reagentes e os produtos esse estado de transição ele não é isolado esse nenhum
outro o estado de transição é um estado hipotético é uma forma imaginária de como os reagentes se juntam para formar o produto eu preciso então fornecer energia suficiente para que o reagente chegue no estado de transição aqui o estado de transição estou representando como sendo a transferência de um átomo de oxigênio do NO2 para o co porque aí então formaria o no e o CO2 para que a reação ocorra além de fornecer a energia de ativação que nesse caso é 132 que Jes é necessário também que as moléculas tenham uma configuração um arranjo espacial que
possibilite a reação Por exemplo essa reação ocorre pela transferência de um átomo de oxigênio do NO2 para o co então o átomo de oxigênio tem que estar voltado para o carbono se esse choque ocorresse entre o nitrogênio e o carbono esse não seria um choque efetivo não seria um choque que favoreceria a reação nesse caso para que a reação ocorra além da energia as moléculas têm que se chocar de uma maneira favorável produzindo então chamados choques efetivos tendo Então essas duas condições a disposição molecular e a energia de ativação eu consigo Então transformar o dióxido
de nitrogênio monóxido de carbono no óxido nítrico e no gás carbônico Mas como que Eu determino como que eu calculo a energia de ativação eu consigo chegar no valor paraa energia de ativação através da equação de arenos a equação de arenos é uma equação que correlaciona a constante de velocidade o k com com parâmetro cinético com a energia de ativação com parâmetro termodinâmico segundo ele a constante de velocidade é igual um a Esse a é um número constante para cada reação é o chamado fator pré-exponencial embutido nele tá o conceito dos choques efetivos na disposição
adequada das moléculas esse fator pré-exponencial que é próprio de cada reação assim como k multiplica uma exponencial elevada a - Ea menos a energia de ativação dividido por RT onde R é a constante dos gases e t é temperatura absoluta em kelv notem que cada reação tem seu k característico só constante de velocidade característica então cada reação também vai ter uma energia de ativação característica ela é próprio para cada sistema normalmente nós não trabalhamos com a equação de arenos dessa forma nós trabalhamos um pouco ela como que nós modificamos é só aplicar o logaritmo neperiano
de um lado e do outro eu vou ter Então essa expressão aqui eu tenho o logaritmo neperiano de um produto né o log do produto é igual a soma dos logs a soma dos logaritmos Então posso escrever como sendo LN de k = LN de a aqui eu terei LN de e elevado a - Ea so RT - e so RT é um expoente então eu posso colocar na frente do logaritmo ele aparece aqui vai me sobrar LN de e LN de e é 1 então por isso eu posso escrever a equação de RN dessa
forma LN de k = LN de a do fator pré exponencial + - RT - EA so RT eu posso ainda trabalhar um pouco mais essa equação e deixá-la nessa forma Por que essa forma interessante porque isso de novo é a equação de uma reta eu tenho LN de k fazendo um papel do Y da variável dependente um sobre a temperatura assumindo o valor de X a minha variável independente ou seja k vai depender da temperatura nós já vimos isso alguns exemplos anteriores o coeficiente angular é - EA so R como o coeficiente angular eu
consigo extrair do gráfico através do coeficiente angular que nesse caso é negativo uma reta decrescente eu consigo obter o valor da energia de ativação uma vez que R é uma constante E se eu quiser saber o valor de a do fator pré-exponencial eu consigo obter não o valor de a propriamente dito mas o logaritmo dele através do coeficiente linear Então vamos ver um exemplo de como nós podemos aplicar a equação de arros e descobrir a energia de ativação de uma determinada reação vamos pegar aqui um exemplo eu tenho alguns valores de temperatura já Expressa em
Kelvin ou 138 100 ela vai aumentando e aqui eu tenho o valor da constante de velocidade nesse caso para uma reação de primeira ordem nota que em 838 k a constante é 0,01 conforme eu vou aumentando a temperatura eu aumento A constante Afinal a constante depende da temperatura e quanto maior a temperatura via de regra maior vai ser a velocidade da reação lembre quanto também maior a constante de velocidade maior é a velocidade da reação existe uma regra empírica que diz que a cada 10º C aumentado a velocidade da reação dobra para temperaturas próximas à
temperatura ambiente ou seja temperatura ambiente hipotética 25º C aumentei para 35 a velocidade da reação dobrou aumentei para 45 ela foi multiplicada por um fator de qu e assim por diante Então vamos ver nesse caso específico o que que vai dar quando nós plotamos um gráfico de constante de velocidade pela temperatura um gráfico direto eu obtenho uma curva com caráter de uma exponencial né ela foi ajustada como exponencial esse último ponto Tá meio fora da curva mas dá um ajuste não tão ruim assim mas também não um ajuste perfeito através dessa exponencial fica difícil obter
o valor de k obter o valor do a do fator pré-exponencial inal no entanto se eu Expresso agora não temperatura e constante mas sim o inverso da temperatura e o logaritmo neperiano da constante de acordo com essa forma da lei de arenos quando Expresso LN de k por 1 sobre T eu Provavelmente vou obter uma reta e de fato quando eu coloco esses valores no gráfico jogo lá no Excel ele me dá um gráfico desse tipo uma reta uma reta perfeita uma reta decrescente afinal o coeficiente angular é negativo e através do coeficiente angular eu
consigo obter o valor da energia de ativação para esse sistema quando eu jogo esses valores coloco no Excel e peço para ele me dar a linha de tendência ele Me fornece a equação da reta que é justa esses pontos nesse caso específico eu tenho Y = menos esse número que multiplica x + 2,346 29,34 6 é o o o coeficiente linear ele corresponde ao logaritmo neperiano de a quando aplico exponencial obtenho então o valor de a o valor do fator pré-exponencial mas o que mais nos interessa é o coeficiente angular o coeficiente angular - 30317
é igual a energia de ativação dividido pela constante dos gases como que eu obtenho então o valor da energia de ativação é fácil vou cortar esse negativo com esse negativo o r eu vou jogar para o lado de cá multiplicando esse valor de forma que eu tenho essa expressão energia de ativação é igual o número né o coeficiente angular vezes o valor da Constante eu não estou utilizando o valor padrão 0,082 até ml por K mol eu tô utilizando outro valor para essa constante que é o 8,314 x 10 a-3 porque eu quero expressar o
valor final em kj então o valor da Constante em kj é esse basta multiplicar e eu obtenho o valor da energia de ativação como sendo 250 kj por mol Essa é a forma mais elegante que nós temos em determinar a energia de ativação de um sistema se eu tiver um conjunto de valores de constante de velocidade para uma dada temperatura eu consigo plotar um gráfico de LN da constante de velocidade pelo inverso da temperatura e através do coeficiente angular desse gráfico eu consigo obter a energia de ativação que ela é própria para cada sistema Como
disse essa é a maneira mais elegante Na minha opinião existem outras formas de determinar a energia de ativação por exemplo eu não tô falando que LN de k por 1 sobre T vai me dar uma reta se vai me dar uma reta eu preciso de quantos pontos para definir uma reta quatro cinco não eu preciso de apenas dois então eu consigo obter o valor da energia de ativação se eu tiver apenas dois valores de constante de velocidade por temperatura Como que eu faço isso lembra que o EA sobre R é o coeficiente angular E como
que eu obtém o coeficiente angular de uma reta é simples o coeficiente angular é a tangente desse ângulo então eu consigo obter a tangente desse ângulo fazendo o Del Y sobre o delx Né o Del Y assume o papel de cateto oposto o delx assume o papel de cateto adjacente a tangente desse ângulo é o oposto sobre o adjacente que corresponde a coeficiente angular nós falamos isso em algumas aulas de cinética passada eu tenho uma explicação mais detalhada isso nas minhas aulas de derivada onde eu faço essa correlação da derivada com o coeficiente angular depois
de uma olhada lá eu vou deixar o link aqui na descrição então se eu consigo obter a energia de ativação através do Delta Y sobre o delx queem é o meu del y o meu del Y é o LN de k num determinado instante final LN de K2 menos o LN de k no instante inicial menos LN de k1 quem é o delx bom delx é 1 sobre a temperatura no estado final 1 sobre T2 Men 1 sobre T1 1 sobre a temperatura no estado Inicial isso aqui nada mais é do que o Del Y
essa diferença aqui o cateto oposto e aqui nada mais é do que o delx a diferença aqui no cateto adjacente através dessa diferença eu consigo obter o coeficiente angular que é EA sobre R notem que para obter a energia de ativação eu preciso apenas de ter dois valores a constante de velocidade e claro a temperatura a qual ela tem esse valor e assim eu consigo obter a energia de ativação através da equação de arros e pessoal gostaram do vídeo bom era isso que eu tinha para hoje eu espero que vocês tenham gostado então por favor
se gostaram deem o seu like Compartilhe o vídeo e se quiser fazer parte do projeto Universidade da química se inscreva no canal como sempre nós temos vários outros vídeos não apenas de cinética química mas de outros tópicos modelos atômicos toque química Fique à vontade para assistir os vídeos compartilhar com seus amigos com seus colegas com seus professores deixar seus comentários vocês serão muito bem-vindos aqui no canal e claro não deixe acessar o nosso site o
Related Videos

15:44
Episódio 11 - Atrasando a Reação! (Reações...
Universidade da Química
15,940 views

14:45
Episódio #9 Quanto tempo você tem de vida?...
Universidade da Química
32,301 views

3:09
2020 04 14 003
Ivan Moraes Filho
1 view

18:05
Energia de ativação (vídeo 1): interpretan...
O canal da química
442 views

19:19
FATORES QUE ALTERAM A VELOCIDADE DAS REAÇÕES
Professor Gabriel Cabral
274,255 views

6:47
ENERGIA DE ATIVAÇÃO
Explicabem André Pakito
175,842 views

14:35
Episódio 5 - Qual será sua concentração no...
Universidade da Química
43,201 views

17:22
Episodio 4 - Colocando ordem nas coisas! (...
Universidade da Química
67,845 views

20:50
A ENTROPIA EXPLICADA
Ciência Todo Dia
2,386,823 views

LIVE California Fires: New Kenneth fire er...
LiveNOW from FOX

9:07
ENERGIA DE ATIVAÇÃO: O que é e Como Determ...
Professor Igor Química
38,446 views

52:06
MegaQuímica #10 Pilhas Eletroquímicas e a ...
Universidade da Química
59,351 views

12:31
USANDO A EQUAÇÃO DE ARRHENIUS | CINÉTICA ...
Khan Academy Brasil
24,469 views

11:33
O que é energia de ativação? |Equação de A...
Professor Thiago
1,679 views

30:30
OUTRO AMOR DO ENEM = CATALISADOR - CINÉTIC...
Café com química - Prof Michel
20,968 views

14:52
Episódio 12 - Como funcionam as coisas? (M...
Universidade da Química
33,085 views
10:47
APRENDA FÁCIL ENERGIA DE ATIVAÇÃO EM GRÁFI...
Diego Fares
6,785 views

11:48
Aula 365.1 - Ordem da Reação
Química Alceudispor
15,693 views

LIVE: Atlanta Winter Storm Updates - Snow,...
FOX 5 Atlanta