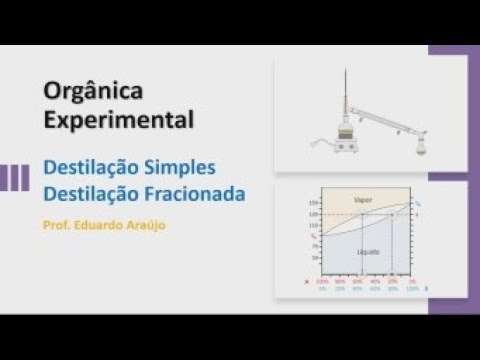
Destilação simples, fracionada e diagrama de fases.
2.38k views4278 WordsCopy TextShare
Química Canal
Neste vídeo faço uma rápida descrição dos processos de destilação simples e fracionada.
Diagrama de ...
Video Transcript:
E aí E aí o Olá pessoal sejam todos bem-vindos a mais essa vídeo aula de química orgânica experimental e o nosso próximo experimento vai ser de destilação simples e destilação fracionada então vou falar para vocês sobre esse processo de separação de mistura é chamado de destilação simples e destilação fracionada agora essas misturas não são misturas quaisquer não que a gente vai falar aqui nessa vídeo aula lá mistura bem específica vai ser uma mistura de um líquido com outro líquido ou de um líquido ou um sólido não vou lá então quando aqui no primeiro momento eu
quero que vocês saibam diferenciar o aparato de fazer a destilação simples é esse aqui ó ski tenta esse outro aparato aqui é o de fazer destilação fracionada vou explicar Qual a diferença entre os dois como que se dá esse processo de destilação mas antes eu queria mostrar para você aqui ó com detalhe Como que é o nome de cada um desse o fatos para fazer destilação simples não tem aqui ó o balão coletor esse adaptador de vaco aqui ó aqui a gente faz vá quando for necessário não em todo o processo que precisa fazer esse
vácuo não só quando for necessário mas isso aqui é um adaptador de vaco isso aqui ó é um condensador vai ter colocado no termômetro aqui ó chama-se cabeça de destilação todo esse aparato aqui ó chama-se cabeça de destilação já isso aqui ó esse aqui ó é o balão de destilação e aqui ela manta de aquecimento agora tem um detalhe importante sobre esse ser mostre qual que é é esse aqui ó em que altura que devemos deixar o termômetro você vai deixar da seguinte maneira com o finalzinho do bulbo aqui ó que é o início do
mundo que é o final do Google ele tem que ficar aqui ó mais ou menos tangente a essa curva aqui ó é isso que eu tenho que é um termómetro Google tá lá para os dois aparatos e o outro aparato que tá aqui é esse aqui eu destilação fracionada eu sou muito tempo parado Se vocês quiser chegar e falar aí o equipamento de destilação fracionada também tá certo pode falar assim mas vamos falar sobre esse aparato aqui destilação fracionada perde Aquilo é muito parecida com extremamente parecidos né com destilação simples por um detalhe né que
tem essa coluna aqui que é chamada a coluna de Figure Pode ser que o balão coletor tem um adaptador de falar com o teu condensador tem o termômetro tem a cabeça de destilação tem a coluna de vigreux e tem esse balão de destilação além da Manta de aquecimento aqui também o bulbo do termômetro tem que ficar naquela altura ali né o finalzinho dele tem que fazer o gente tem que ficar tangente a essa curva aqui ó agora um detalhe muito importante mas extremamente importante lá no laboratório e essa parte aqui debaixo aqui ó a entrada
de água e aqui ó essa saída é a saída de água tem alguns condensadores que esse essa saída de água tá aqui do lado de cima e é o ideal tá bom a ideal que fica tipo lá de cima mas essa figura aqui eu Só encontrei essa figurinha com essa parte aqui para baixo Então tudo bem muito bem agora vamos falar sobre o novamente né sobre esse processo de destilação só que agora vou detalhar para vocês como que acontece essa destilação simples né Então vem aqui ó aqui tá vendo isso aqui aqui que é o
processo de destilação simples deixa aproximar mais um pouquinho aqui ó do balão de destilação e mostrar pra vocês Olá vamos ligar isso aqui lá na energia elétrica e que que vai acontecer vai acontecer um aquecimento quando tiver acontecendo esse aquecimento tem que vai aqui que vocês vão observar vocês vão observar a formação de vapores é desse jeito aqui ó esses vapores uma coisa muito importante que eu esqueci de falar para vocês mas eu vou ter que falar agora é o seguinte que aqui no líquido a gente tem que colocar umas Pedrinhas de ebulição para que
a ebulição não seja muito rigorosa se essa posição foi muito rigorosa pode estourar o sistema outra coisa muito importante é que essas Pedrinhas de ebulição que a gente coloca aqui elas têm que ser colocadas enquanto esse líquido estiver resfriado muito bem e aí o que que acontece então esses vapores vão subindo aqui né vai subir vai subir chega aqui o Nessa altura aqui ó a tendência deles é descer por aqui assim ó volta mostrando aqui ó tá vendo desse seu lá e aí quando eu chego aqui no condensador que que vai acontecer ele se liga
faz e nessa carinha aqui ó tá vendo aqui começa a pingar aqui e deverão observar quando começar a gotejar aqui vocês controlam em essa temperatura aqui não deixe mano ebulição muito vigorosa e o ideal é que aqui ó ping no máximo três gotas por segundo Maceió Muito no máximo mesmo o ideal é de uma a duas gotas não de gotejando por Porto Seguro tá bom isso é ponto segundo tá Então veja só a destilação simples e processa desse dessa forma agora em que caso que é indicada a destilação simples bom indicado quando tem dois componentes
né Se for dois litros dois líquidos que apresentam uma temperatura de ebulição e são muito diferentes mais assim muito diferente mesmo o recomendado é que seja assim essa diferença acima de 100 graus celsius porquê disso mas na é para vocês qual quando se tratar de um sólido de elevada temperatura de fusão solubilizado em um livro em Então é isso que recomendo recomendado para destilação simples os vamos continuar Vamos falar agora sobre o que vamos falar sobre a destilação fracionada vão detalhar destilação fracionada o Instagram como eu tinha já mostrar para vocês aí está o equipamento
de destilação fracionada nunca esqueça que a entrada de água aqui por baixo e a saída da água ali por cima que vem aqui para resfriar aqui o condensador agora qual que é a diferença entre esse processo de destilação fracionada e a destilação simples No que diz respeito a esse aparato é a presença dessa coluna aqui a coluna de destilação nesse caso aqui é chamado de coluna de ver deixa eu trabalhar aqui para vocês como que é essa coluna de viria aqui né Aqui está ela isso é que eu fiz aqui no desenho aqui no PowerPoint
mesmo então ficou muito legal aqui diz mais mais mais parecido com a realidade perceba vocês que é o seguinte né que como é que faz isso aqui se vocês verem isso aqui ao vivo lá no laboratório eles vão perceber que é o seguinte isso aqui é como se você tivesse e enfiando uma agulha no vidro e esse vidro entrou para dentro Imagina assim você colocando o dedo numa uma bexiga e empurrando a bexiga para dentro é desse jeito Isso aqui agora isso aqui ó Fica de frente para esse Só que tem um aqui na frente
outro lá atrás e aqui ó faz um ângulo Zinho de mais ou menos 45 graus tá então isso aqui a coluna desvirei é a mais utilizada nos Laboratórios de ensino tem também uma coluna que ela é desse jeito aqui por quê que é toda feita de vidro igual a coluna de vigreux Só que tem um detalhe A invés de fazer esse esses nossas entranhas aqui né digamos assim essas entranhas faz o que coloca esferas de vidro aqui dentro para essas esferas não cair por aqui coloca uma de malha de aço inox aqui embaixo essas Pedrinhas
não cair aqui que ela por esse buraco aqui tá essa rosca isso é aqui que a gente chama isso de rosca e melhor esmerida né esmerilhada E aqui assim uma outra coluna que é preenchida não por esferas mas sim por esses tubos aqui que a gente chama de todos os de vidros né o nome simples espera de vidro e tubo de vidro então este a coluna com esses tubo de vidro e pronto acabou então isso aqui é muito utilizada em laboratório tá bom vocês vão ver que lá no nosso laboratório a gente vai usar essa
aqui que a coluna de vidro ele está mas vamos voltar aqui como que é o processo de destilação fracionada então processo é muito parecido com o processo de destilação simples novamente a gente liga a o aquecimento aqui na manta de aquecimento nunca esquecer de colocar as Pedrinhas de ebulição aqui e aí o que que vai acontecer vai formar um ao outro caso vai formar os vapores esses vapores vão subindo vão subindo vão subindo para chegar aqui no termo e pode até reparar Quando vocês forem fazer essa aula e esse termômetro aqui ó quando ele começa
a chegar os vapores nele a um aumento significativo aqui na temperatura que vocês vão registrar aqui nesse termômetro aí o que que acontece chegando aqui vem aqui para o condensador Vocês estão vendo ali chegou ali no condensador esses vapores começam a condensar e vou formar gotículas aqui desse material que está sendo separado não é assim que acontece muito bem agora eu queria mostrar uma outra coisa para vocês aqui bem interessante Qual que é o que que acontece nessa coluna aqui né Qual que é a função dessa coluna vocês vão reparar que vou formar gotículas no
da mistura aqui do solvente que for mais volátil não informações gotículas que vocês estão vendo aqui tá então quer dizer o seguinte essas gotículas elas vão ser formadas mas Por conta desses eu estarei muito aquecido essas gotículas elas evaporam novamente mas em que em que caso que é indicada a destilação fracionada indicado sempre que você tiver a mistura de dois solventes que apresentam apresentam pontos de ebulição ou temperaturas de ebulição não diferente de tipo 80 graus 90° inferior a 100 graus sempre é indicado essas destilação fracionada por exemplo etanol água à mistura e canal água
é indicado uma destilação fracionada tá nunca destilação sim mas isso sobre essas essa coluna aqui qual que é a teoria e está relacionada um esse processo de destilação simples destilação fracionada é sobre essa teoria que eu vou falar agora com você está então comprou lá e aqui está isso que eu vou montar para vocês se chama diagrama de Fases como que é esse diagrama de fase não deixou Antes de mostrar para vocês bem assim e é o seguinte que que é isso aqui você quer temperatura temperatura uma mistura qualquer o uma substância pura qualquer isso
aqui também a temperatura tudo que vai aparecer aqui ó vai ser temperatura tudo que aparecer aqui vai ser temperatura e o que que é isso aqui ó tem dois conjuntos de números aqui embaixo e é isso aqui isso aqui é totalmente de uma mistura de componente a isso aqui xô Neide componente B é o percentual em mol de meio mas esse percentual irmão é o mais comum pode ser um percentual em massa pode ser percentual em volume Enfim pode ser qualquer o e expressão percentual só que o mais comum é percentual em ó em Ball
ele também pode chamar de fração molar agora olha só aqui ó quando eu tô aqui eu em cima do sem aqui dizendo esse aqui significa o tio Ah tá puro aí a gente vai andar em cima dessa linha aqui tá bom isso aqui então é para o componente a puro e do outro lado aqui ó o componente B puro Então tá ok agora veja só o que que eu vou fazer vamos fazer o seguinte eu vou colocar aqui ó essa figura o que que é isso professor já já vocês vão entender aqui ó que tá
em azul sempre vai estar na fase ligue o quê que significa isso significa o seguinte se eu tiver por exemplo uma mistura de sessenta por cento de ar um quarenta por cento de b e tiver na a temperatura de 50 graus Celsius ele vai tá em Abolição ou vai tar na fase de vapor nenhum nem outro ele vai estar a 50 graus Celsius ele não vai estar fervendo aí você vai aumentando aumentando vai aumentando a temperatura quando aquele ferve não chegar nesse ponto aqui ó em cima dessa linha onde eu tô passando o cursor qualquer
uma dessas composições começa a ferver entre em ebulição agora o detalhe aqui ó se tiver aqui em cima dessa linha vai estar 100% bebê então aqui ó nesse ponto aqui é a temperatura de ebulição do líquido Berê e nesse ponto aqui ó vai estar 100% a vai ser a temperatura de ebulição de ar outra coisa muito importante é que é ó e aqui em cima que tá aparecendo aqui ó vai ser a composição dos vapores lembra que ainda porque eu falei para vocês Bem Assim Que na destilação simples ou na destilação fracionada a gente aquece
ele entra em ebulição aí forma os vapores é qual vai ser a composição do vapor vai ser aqui em cima que a gente vai descobrir eu vou colocar aqui com um exemplo isso aqui ó vamos supor o seguinte que eu tenho uma mistura de ar com b eu chamei de mistura w em que tem vinte por cento de ar e oitenta por cento de bebê antes de começar aquecer o beba é que sendo vai Aquecendo Vai aquecendo igual mostrei aqui ó Nessa linha pontilhada aqui quando chega nesse ponto aqui ó tá vendo esse ponto aqui
ó eu chamei de ter essa aqui ó é a temperatura de ebulição dessa mistura w em muito bem então tá então essa aqui ó é a temperatura de ebulição e qual é a composição desse líquido que tá fervendo Vinte por cento de ar e oitenta por cento de bebê OK agora ele tá fervendo e tá gerando para por qual seria a composição do vapor aí você vai pegar uma régua e vai fazer uma linha horizontal nessa direção aqui ó essa vai ser a composição do vapor de dessa mistura W E qual é essa composição desses
vapores desses vapores aqui ó a composição vai ser essa aqui que eu chamei dizer então essa é a composição desses vapores compreenderam veja que o vapor mundo tem dúvida por cento dia e oitenta por cento de p&d ver esses vapores é mais rico no componente ar do que a solução original lá ar que deu origem a esses vapores se desesperar hora a temperatura de ebulição do componente a é mais baixa significa que ela é mais lado eu vou colocar aqui um outro exemplo para vocês para a gente detalhar melhor toque uma mistura A e B
A aqui ó 100% 80 60 40 20 até chegar em 0 a mesma coisa aqui lembre-se tudo qualquer uma dessas temperaturas aqui abaixo dessa linha não vai tá em ebulição ali entra em ebulição quando chega nesse ponto aqui então tá então vamos explicar para vocês o que que acontece e veja só nós vamos partir do SIM A partir dessa mistura aqui ó aproximadamente aqui quando 77 de a e 93 de 6 com você aquece vai que você não vai crescendo quando chega por cima ele entra em ebulição ao entrar em ebulição vai gerar vapor qual
vai ser a composição desse vapor mais essa composição aqui eu vou chamar aqui ó tá vendo é essa composição beija que ficou mais rico em a a esses vapores aqui tem essa composição esse esses vapores condensam-se na hora que ele condensa ele condensa com essa composição veja tá mais lipinha o mais pobre lembrei do que o líquido de partida aí o que que vai acontecer e eu posso fazer uma outra pegar ela veja bem esses vapores chegaram aqui condensaram e agora eu posso fazer uma outra destinação se eu fizer uma outra destinação quando chegar nesse
ponto aqui ó eu peguei indo para cá tá porque aquele se liquefez então a gente pega e faz o que não dá para cá agora nova composição veja só deixa eu lembrar vocês eu fiz uma destilação aí ele evaporou é ser a composição do favor aí chegou aqui que que aconteceu o resfriei esses vapores e ele condensou ao condensar ele tinha essa composição aí eu pego essa amostra evapora novamente esses novos vapores terão essa composição aqui ó tá vendo aqui essa composição evaporou aqui vapor e voltou evaporou voltou aí eu pego essa mostra aqui ó
e vou levar para novamente olha nova composição então se eu fizer uma duas três destinações quanto maior o número de destilações maior vai ser a pureza desse que é mais volátil aí ó se eu fizer se eu pegar aqui ó Nessa composição pizza de novo resfriamento esses vapores se tornar uma líquido esse líquido vai ter essa composição aí eu faço outro evaporação tá vendo aqui quanto maior o número de evaporações mais pura vai ser o a sua mostra a obtida lá no final a separação obtidas Pois é isso que acontece mas tem algum nome especial
para isso tem sim não deixa eu mostrar aqui para vocês e esse tensa capacidade de pegar ele e depois começar evaporar começar evaporar condensar evaporar condensar e assim por diante quem é que tem essa quem é que consegue fazer isso essa coluna aqui ó que a gente chama de coluna de igreja ou a coluna de destilação essa coluna aqui que faz essas várias destilações e como que a gente chama essas várias destinações a gente chama de destilação fracionada a Então olha só aqui ó tinha concentração um ver se transformou na concentração dois aí evaporou de
novo virou uma concentração três evaporou de novo virou uma concentração quatro porque chamado isso como é que é chamado essas várias destinações que podem ser feitas a que horas é que foi feita uma destilação a segunda terceira se chama isso de pratos teóricos esses pratos as pessoas quantas possíveis deste lações podemos fazer numa coluna de destilação fracionada só para vocês ter uma ideia né Vocês saberem assim mais ou menos é o seguinte quanto maior for a diferença da temperatura de ebulição entre a substância e a substância B menor vai ser o número de pratos teóricos
necessários para promover uma destilação lembra ainda porque eu falei para vocês ver se o na destilação simples é recomendado para fazer destilação simples que Quais são as misturas aí eu falei bem assim são misturas em que o temperatura de ebulição a diferença da temperatura de ebulição dos dois solventes seja superou 100 graus celsius se for superior a 100 graus celsius se eu tiver um líquido ali que ferver o 50° o outro ferve assento e Setembro aí você pode fazer um destilação simples porque só vai precisar de um prato até o único aqui ó o número
de pratos teóricos necessários agora se for assim a diferença de temperatura porém 72cells Aí precisa fazer uma coluna de destilação fracionada Por que só na coluna de destilação fracionada que é possível fazer várias destinações você pode eu tô fazendo a destilação simples mas você vai ter que coletar e fazer de novo coletar e fazer de novo aí dá muito trabalho essas várias destinações quem faz a coluna de destilação fracionada só para vocês saberem né quanto menor for essa diferença das temperaturas de ebulição do líquido aquoso líquido B maior vai ser a quantidade de pratos teóricos
ou seja maior número de destinações a serem feitas para promover uma boa separação veja só quando tem dois a temperatura de ebulição muito próximo você precisa de 100 para os teóricos deixa eu mostrar aqui para vocês novamente né não tá aqui ó tem a destilação simples e destilação fracionada é que tá o número de pratos teóricos que é possível fazer aqui ó nessa nessa coluna que por exemplo e quanto maior quanto mais alta for uma coluna de destilação fracionada olha vai ser o número de pratos teóricos possíveis nessa coluna também eu queria que vocês entendessem
isso de maneira bem clara tem tranquilo Tudo bem pessoal E o que mais eu tenho para falar para vocês um cristal queria mostrar isso aqui para vocês mas não olhe com espanto para isso não só que eles são aquelas misturas que a gente chama de misturas azeotrópicas é muito bem tem isso tem que ir você consegue elevar a temperatura de ebulição numa determinada mistura-se ao tipo acionar determinada composição essa seria a palavra mais mais adequada numa determinada composição aqui você consegue elevar a temperatura de ebulição peça mistura membros que nesse ponto aqui ó seria o
componente apuro nesse outro ponto aqui ó seria o componente B puro nesse ponto aqui Octa cima do ar puro e do B puro a gente chama de diagrama nesse diagrama aqui ó um ponto mistura com todo de ebulição máxima porque está maior QE substância pura e a substância de pura Mas pode acontecer também e isso aqui ó em que a temperatura de ebulição dessa dessa mistura que hora dessa composição da mistura é menor do que a a evolução nesse caso aqui o etanol puro e aqui ó a água pura que seria a próxima aqui seria
Almeida do mar 100 graus celsius isso aqui 78,4 e aqui ó tem uma composição que composição etanol água que apresenta temperatura de ebulição inferior a temperatura de ebulição do etanol puro e da Água pura Então vamos dar uma olhada aqui nos nesse primeiro caso né que é o caso da mistura etanol água então vamos lá vamos ver isso aqui porque está lendo isso aqui seria a água pura isso aqui seria tá no futuro se eu tiver com essa composição aqui por exemplo Nossa composição aqui ó em que tem um pouquinho quer dizer pouco ar álcool
e bastante água exemplo uma cerveja né eu tenho os componentes e vamos falar assim ó algum torno de Seis por cento de etanol e noventa porcento de água tá vamos supor essa composição Isso aqui vai ferver abaixo de 100 graus celsius nessa nesse ponto que começa a perder e esses vapores serão ricos em etanol em relação a mistura no estado líquido o que que vai acontecer vai se condensar se tiver lá na coluna de fracionamento vai condensar nessa composição Sírio continuar fazendo as destinações lá na coluna de destilação e que vai acontecer de novo vai
enriquecer essa mistura em etanol e de novo mas se condensar aqui é isso Olha bem aqui assim ó tá vendo quase não dá para enxergar é uma setinha aqui essa mistura aqui ó que corresponde a 95,6 por cento de etanol em água é aquela mistura que a gente chama de mistura azeotrópica agora percebo vocês que com essa composição aqui ó ele não anda nem para direita nem para esquerda porque chegou no ponto de mínimo que que significa isso significa que você não consegue separar mais o álcool da água por um processo de destilação seja ele
destilação simples ou destilação fracionada Então esse é o grande pulo do gato essa aula aqui por quê que não é mais possível separar misturas de etanol-água com 95,6 por cento de etanol Por que atingiu aquele ponto que a gente chama de pão fazer outro agora e no outro caso vamos voltar aqui que é o caso aqui como que funciona ou então vamos ver a quase a mesma coisa ó se você tiver uma mistura dessa aqui ó se você tiver aqui ó nesse lado aqui a gente nunca vai chegar nesse aqui ó você tiver aqui que
que vai acontecer você vai aquecer né com essa composição dessa mistura vai aquecer chegando aqui vai evaporar os vapores terão essa composição depois esfria aumenta de novo resfria evapora resfria evapora agora com essa composição veja perceba vocês quando eu tenho esse ponto de máximo eu consigo fugir desse ponto aqui ó que inviabiliza a separação a essa separação aqui só não é possível você tiver essa composição especificamente alguns exemplos dessa mistura que compõe ponto de ebulição máxima só essa esses exemplos aqui ó esses azeótropos a a acetona clorofórmio clorofórmio metil-etil-cetona ácido hidroclórico ácido acético com a
mistura dioxano e bens aldeído fenol mundo bem mas qual é o ponto desse azeótropo Vinte por cento de acetona oitenta por cento de chronoform já isso aqui olha dezessete por cento de clorofórmio com oitenta por cento de metil etil cetona nesse caso aqui ó Ácido hidroclórico é uma composição de ácido clorídrico de 20,2 por cento e setenta e 9,8 por cento de água e assim por diante o se você tiver uma misturar ácido acético dioxano você não consegue separar essa mistura quando você tiver 77 por cento de ácido acético ou 23 por cento detecção nossas
temperaturas de ebulição eu sou essas temperaturas que vai estar aqui ó nesse ponto aqui em relação aquele outro esse aqui ó esse diagrama que ficou grande exemplo volta o grande exemplo da mistura e canal Então é isso que eu queria falar com vocês pessoal se vocês gostaram desse vídeo seis de seu like se inscreva no canal do professor e o próximo vídeo eu vou falar sobre destilação por arraste de vapor até a próxima aula
Related Videos

17:37
Determinação experimental do ponto de ebul...
Química Canal
2,157 views
12:12
Convertendo mg/dm³ para kg/ha
Química Canal
934 views
7:41
Passando de cmolc/dm³ para mg/dm³
Química Canal
4,727 views
38:29
Forças intermoleculares
Química Canal
560 views

9:24
Carboidratos: Mecanismo de Formação de Hem...
Química Canal
3,021 views

16:53
O que você NUNCA vê antes de SEU VOO | EP....
Aviões e Músicas
229,944 views

46:14
🚨COMO TER UM DISCURSO MAGNÉTICO?🚨
Cíntia Chagas Fã-Clube
7,495 views

58:01
Making an atomic trampoline
NileRed
2,913,648 views

18:02
A psicologia do vestir - parte 2 - Como a ...
Gardênia Régia
43 views

36:31
Mini Excavator Blade Repair
I C Weld
42,993 views

17:54
Exercícios Lei de Lambert Beer Parte 3 -...
Química Canal
2,439 views
7:47
Exercícios Lei de Lambert Beer - Parte 1
Química Canal
6,564 views
12:53
Hidroboração e oxidação de alquenos
Química Canal
1,531 views

10:00
Carboidratos: Mutarrotação da Glicose - Pa...
Química Canal
4,882 views
14:20
Mecanismo da reação de bromação de alquenos.
Química Canal
903 views

2:06
Innovative demining technologies are being...
Програма розвитку ООН в Україні / UNDP Ukraine
1 view
13:57
Exercícios Lei de Lambert-Beer - Parte 2
Química Canal
3,549 views

8:59
Clivagem Oxidativa de Alquenos: Mecanismo ...
Química Canal
796 views

6:20
Açúcares redutores
Bioquímica UFES
3,939 views
9:04
Formulação de íon fórmula de compostos iôn...
Química Canal
167 views