Webinar - Avaliação das notificações recebidas pela Anvisa
1.41k views11822 WordsCopy TextShare

Agência Nacional de Vigilância Sanitária
Principais motivos de cancelamento e solicitação de correções.
Webinar ocorrido no dia 09/12/2024
Video Transcript:
2 Boa tarde a todos eh primeiro eu gostaria de agradecer a a presença de todos aqui né na nosso webinar eu me apresentando sou Patrícia Andreotti sou gerente da área de regularização de alimentos aqui da Anvisa eh gerência que fica né na gerência Geral de alimentos e hoje a gente vai apresentar então um webinar né Para para que a gente possa apresentar para vocês a avaliação que foi feita nas notificações até então recebidas pela Anvisa a gente vai apresentar os principais motivos de cancelamento e também de solicitação de correções Então vamos lá bom esse webinar
ele tem o objetivo de apresentar os resultados Tod as avaliações das notificações que nós recebemos aqui no período de 1eo de Setembro até 30 de novembro nós vamos também apresentar os principais motivos de cancelamento e solicitação de correções de notificação nesse período E também temos né como objetivo orientar os participantes sobre as melhores práticas pro envio das notificações Então o que a gente pretende aqui é falar um pouquinho que a gente tem recebido eh O que é que vai o que que tá gerando né Eh motivações para eh cancelamentos ou correções e dizer né dar
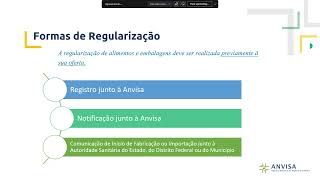
uma orientação de como é o melhor preenchimento do formulário ou a melhor apresentação dos documentos para que a gente possa evitar Então essas inconsistências e também garantir a conformidade regulatória começar dando uma introdução aqui né sobre as normas eh e também sobre a a forma de regularização de notificação eh as normas né RDC 843 e a instrução normativa número 281 elas entraram em vigor no dia 1eo de Setembro né Elas dispõem sobre a regularização de alimentos e embalagem sob competência do snvs e a instrução normativa Ela traz aí as formas de regularização das diferentes categorias
de alimentos e embalagens e também a documentação que deve ser apresentada no momento dessa regularização paraa autoridade regulatória competente essas normas estabelecem três formas de regularização registro junto a Anvisa que nesse caso Anvisa precisa fazer uma avaliação prévia né do da documentação publicar um registro em do e só então a empresa pode comercializar esse produto a notificação junto a Anvisa que é o que a gente vai falar aqui hoje né que é a empresa ela notifica apresenta uma documentação para Visa mas automaticamente ela já pode comercializar a partir do momento que ela recebe o número
do processo de notificação ela já pode comercializar né então não existe uma avaliação prévia mas a VISA pode avaliar esse essa documentação a qualquer tempo eh e o comunicado de início de fabricação e importação que é feito junto à Autoridade Sanitária do estado do Distrito Federal ou do município as categorias que a gente vai tratar hoje aqui que são as sujeitas né a notificação elas para serem regularizadas elas precisam ser notificadas na VISA eh água doada salinizada potável inv vazada alimentos com alegações de propriedade funcional de saúde alimentos de transição para alimentação infantil alimentos para
controle de peso cereais para alimentação infantil resina e artigo precursor ou embalagem final de pet PCR grau alimentício e os suplementos alimentares eh a norma né ela fala que eh o detentor da regularização então o responsável pela regularização perante a Anvisa é a empresa que solicita a regularização né E quem vai ser essa empresa essa empresa emesa quem faz essa notificação né a empresa é a Matriz do fabricante ou um representante do fabricante ou importador quando a gente fala de Matriz do fabricante eh eu queria deixar esclarecer um ponto que nós temos recebidos alguns questionamentos
eh de um exemplo assim a empresa eh a matriz da empresa fabrica medicamento e o a uma filial é que fabrica suplemento Então quem é que tem que solicitar a regularização nesse caso específico né Eh quem tem que solicitar a regularização é a matriz né a matriz Independente se ela só fabrica medicamento então a norma diz que é a matriz que solicita e ela informa né lá no formulário de de notificação quem é o fabricante e o fabricante Então vai ser AF filial né então são CNPJ diferentes nesse caso né é importante falar também que
o artigo 5to da Norma Ela diz que a detentora da regularização ela é responsável por garantir a veracidade a correção e a atualização das informações apresentadas nos procedimentos para regularização é ela quem responde pela garantia dos requisitos sanitários de composição qualidade segurança e rotulagem estabelecidos pro produto ela que solicita alteração de eh das informações prestadas solicita a revalidação ou a manutenção da da notificação que é o caso aqui e também solicita o cancelamento quando não existe mais interesse na oferta daquele produto isso é muito importante porque quem eh apresenta a documentação né quem quem vai
ser a detentora dessa regularização é ela que tem que conhecer né tem que conhecer o produto tem que saber do produto e apresentar todas as informações para agente eh todas as empresas seja detentoras ou seja fabricantes de alimentos né notificados Eh elas precisam ser cadastradas no sistema da Anvisa né no nosso cadastro de alimentos e elas também precisam manter esse cadastro atualizado as empresas nacionais esse cadastro é feito pela própria empresa lá no sistema solicita e as empresas internacionais esse cadastro é feito pela Anvisa a partir de informações declaradas lá no processo de notificação eh
então a gente vem recebendo alguns questionamentos sobre como que as empresas nacionais atualizam esse cadastro porque algumas empresas eh já possuem um cadastro na Anvisa né Eh teve um cadastro alimentos validado anteriormente só que agora elas precisam atualizar esse cadastro que esse cadastro tá com o endereço antigo ou com responsável eh legal diferente e aí elas nos perguntam muito sobre isso então a gente queria a gente já colocou essas informações na no site da Anvisa né de como isso é feito mas eu vou apresentar aqui para vocês o que tá lá no site né então
a própria empresa então lá no no site da da visa a gente tem lá né Eh cadastro de empresas no sistema aí tem Quais as empresas devem ser cadastradas tudo aqui isso aqui que eu falei por último aqui tem como atualizar o cadastro de empresas no sistema da Anvisa então a empresa deve atualizar os dados no próprio sistema de cadastro e protocolar petição específica no sistema solicita para a validação e alteração da informação no cadastro de alimento os códigos de assunto e a documentação necessária para o peticionamento pode ser acessada no consulta então aqui no
consulta de alimentos consulta de assunto se a gente colocar cadastro Então vai ter os códigos alteração de razão social no cadastro de alimentos alteração de endereço da empresa alteração de responsável técnico legal eh exclusão de empresa do cadastro de alimentos né Então essas informações eh tão aqui no site né Eh depois da publicação da Norma eh Nós também fizemos uma atualização aqui das orientações do site Então se a gente entrar aqui né lá no regularização de produtos e serviços alimentos Então a gente vai ter aqui um um CAD aqui de regularização de alimentos embalagens que
tem várias orientações aqui sobre como peticionar registro notificação comunicar né além das orientações que a gente tem no próprio documento de perguntas e respostas também eh vou falar pouquinho das apresentaes de produtos então a ela define que um produto ele pode ter diferentes apresentações né E essas diferentes apresentações elas podem ser solicitadas junto no mesmo processo de notificação e o que que a noma trata como diferentes apresentações eh são produtos que se diferenciam pelos tipos ou concentração de aditivos alimentares utilizados na função de corante Ou de aromatizante ou de ingredientes que são utilizados para essa
função também de conferir sabor eh cor ou aroma ou tipos ou materiais de balagem então apresentações são só esses essas diferenças né quando o produto se diferencia por meio dessas características aí são diferentes apresentações antes né na Norma anterior a gente falava de diferentes apresentações para diferentes fabricantes também a 843 não trouxe essa questão né então os diferentes fabricantes eles também vão ser colocados né se um produto tem diferentes fabricantes eles vão ser listados no campo lá fabricantes Mas isso não vai configurar uma nova apresentação pro produto né ele só vai listar os fabricantes a
mesma coisa para as marcas né se ele tem outras marcas produto é igualzinho só muda marca as marcas também são listadas lá eh paraas diferentes apresentações são utilizados o mesmo número de notificação porque é gerado apenas um número de processo né então um número de processo para todas as apresentações então é esse vai ser o número de notificação de todas as apresentações do produto uma coisa muito importante é que nós eh temos eh recebido algumas eh solicitações né algumas notificações onde colocam apresentações eh com formas farmacêuticas diferentes por exemplo suplemento alimentar em solução oral e
um suplemento alimentar em cápsula né os dois por exemplo são suplemento alimentar de eh vitaminas um é em cápsula e outro é solução oral isso não são diferentes apresentações né a norma não trata isso como uma apresentação são diferentes produtos são diferentes processos né todo o cálculo toda a análise que é feita nessas formas farmacêuticas são individuais né Então até mesmo o no caso de suplemento até mesmo a designação do produto nesse caso né da designação que vai est apresentada para no banco de consultas ela é diferente né uma é uma solução oral e a
outra em cápsulas então Eh são produtos diferentes tá então você atentar que eh formas farmacêuticas não são diferentes apresentações de acordo com a 843 a a notificação ela é protocolada né Eh por meio de código de assunto específico então para cada uma dessas categorias de produto a gente tem um código específico eh a petição ela deve ser instruída com os documentos do anexo 10 da in 281 então aqui falando um pouquinho né desses documentos Então ela traz a in traz para cada tipo de categoria de alimento e embalagem Ela traz quais são eh os os
documentos que precisam ser anexados né Deixa eu só voltar aqui eh caso o produto possua mais de uma apresentação A petição devee ser instruída com as informações sobre todas elas né a notificação mais uma vez é de forma automática não precedida de avaliação pela Anvisa n então não há eh diferente do registro não há uma publicação em doou eh autorizando né a Anvisa não autoriza a empresa notifica e ela se se compromete né notificar de acordo com a legislação produzir o produto de acordo com a legislação e ela já pode de comercializar a qualquer tempo
a VISA pode avaliar né e a oferta do produto no Mercado somente pode ser iniciada após o protocolo da notificação a rotulagem do alimento notificado deve conter a declaração da informação alimento notificado na VISA seguido do número completo do processo de notificação aqui também um ponto importante né a gente recebe muitas eh muitos questionamentos eh se pode manter a frase eh alimento isento de registro conforme eh RDC 240 ou eh 27 né então assim não né Essas rdcs Elas já foram revogadas e nem mesmo elas tinham essa previsão né a gente nunca teve a previsão
de eh listar no na na no rótulo do produto que aquele eh produto era dispensado de registro né era exento de registro não tinha essa obrigatoriedade então isso não é não é nunca foi né E também não é não é permitido hoje né O que precisa estar Obrigatoriamente eh no rótulo dos alimentos que foram regularizados na forma de notificação é exatamente essa né alimento notificado na anva e seguido do número completo do processo de notificação n também a gente recebe muitos questionamentos sobre variação textuais não ele não é permitido variações textuais né nessa eh nessa
declaração e também eh questões como Ah eu posso colocar alimento notificado na Anvisa e o número colocar vi tampa não não tem né tem que ser seguido a norma é bem clara né tem que ser seguido do número completo do processo de notificação aí eu queria apresentar também aqui né a o banco de consultas quando a gente fez os primeiros webinares né a gente ainda não tinha não tinha acontecido nenhuma notificação ainda então eh a gente ainda não tinha exemplos Claros né dessa consulta como essa consulta ia ser realizada Dev ser feita eh no site
então eu vou entrar aqui para dar alguns Alguns esclarecimentos né então a gente entra aqui eh no sistema de consultas da VISA escolhe alimentos aqui a gente tem opção de uma busca avançada né que tem por eh por várias características aí dos processos informações do processo da empresa do produto aí eu vou fazer uma busca por todos os notificados né Eu escolho aqui notificados e coloco consultar então ele vai me dar uma lista aqui de todos os produtos que foram até então notificados na Anvisa né Eh a gente pode fazer uma exportação aqui para Excel
né para para olhar todos esses dados então todos esses dados vão tá lá e a primeira coisa que a gente vê aqui é que alguns produtos estão ativos né com essa com esse status azulzinho aqui e outros estão inativos né O que que significa isso quando o produto ele entra né Ele é notificado na Anvisa automaticamente lembra que eu disse que a notificação de forma automática não precedida de avaliação eh automaticamente ele entra como ativo né então isso significa que o produto foi notificado na VISA né Eh quando o produto tá inativo tá esse vermelhinho
aqui significa que ele não não pode ser comercializado né a Anvisa nesse caso aqui a Anvisa avaliou e cancelou esse essa notificação Então essa notificação tá V tá como inativa eh os que estão ativos né Eh não significam que a gente avaliou e tá ok né significa que eles estão regulares Porque estão notificados né E não teve nenhuma ação ainda eh nesses produtos e eles mantém aqui o seu prazo de vencimento né do da regularização que para todas as as notificações que entrarem até 2029 né vai ser 2029 né então são 5 anos a partir
do momento da vigência da Norma aqui dentro dos se a gente clicar em um dos produtos a gente consegue ver todas as apresentações do produto né Eh se alguma apresentação aqui também tiver sido cancelada apenas uma vai est aqui inativa e outra ativa né Eh e a gente consegue fazer a busca aí pelo pelos fabricantes né pelo eh pela lista de ingredientes de cada uma da das apresentações aqui do produto bom a avaliação da notificação então a norma né como eu já já falei aqui ela prevê que a gente faça a avaliação eh depois desse
produto notificado e a a gente pode fazer avaliação ou solicitar informações adicionais né necessárias então no caso de detecção de incorreções nessa avaliação a anisa ela pode da ciência detentora sobre as correções necessárias na notificação do produto E o respectivo prazo para adequação então isso aqui não é uma exigência como num processo de registro né É apenas uma solicitação apontando o que é que deve ser corrigido então a gente encaminha um ofício paraa empresa solicita o eh qual é o ponto da da notificação que eu precisa ser corrigido e dá um prazo para que isso
seja feito né Eh Ou a gente mesmo pode dependendo da da correção né a ser feita eh nós depois eu vou dar alguns exemplos Quando eu falar das avaliações mas nós mesmo podemos corrigir né E só dizer Olha nós corrigimos a sua notificação nesse ponto e você você precisa adequar o seu produto né eh e aí se o produto já tiver sido ofertado ao mercado Qual é o prazo que tem a depender né da da da classificação da do risco né ou da criticidade desse dessa correção Ou a gente pode cancelar a notificação do produto
e a gente cancela e d ciência detentora sobre as medidas a serem adotadas Então se o produto tá notificado E tá no mercado se ele tem incorreções que representam risco à saúde do Consumidor ele precisa ser recolhido né então o próprio parecer de cancelamento ele já traz Qual é a a ação né A medida que a empresa precisa adotar em relação àquele produto eh depois a dentro da desse processo de notificação nós vamos ter ainda a manutenção da notificação né que seria uma revalidação vamos P desse produto ela é um pouquinho diferente da revalidação de
registro por exemplo ela é uma petição única para todos os produtos notificados pela pela quera detentora ela tem um período específico para acontecer né então a a nossa nosso próximo período né para as empresas declararem interesse né manifestarem interesse eh pelas notificações vão ser de 1/10 a 31/12 de 2029 né como eu disse lá todas todas elas vencem em 2029 eh e quem não declarar né quem não o produto que não fori manifestado interesse lá nesse nesse prazo né Desses desse período ele fica como inativado né ele também vai ficar como inativado quer dizer não
tá sendo comercializado na empresa não tem interesse naquele produto caso aconteça alguma coisa né ou que teve problema que a empresa talvez esqueceu de de fazer a manifestação naquele período ou eh resolveu que vai voltar a produzir e comercializar aquele produto que já teve uma notificação anterior não teve nenhuma alteração né aí ela pode fazer a reativação dessa notificação né Depois que tiver inativada reativação da notificação eh e peticionando individualmente essa solicitação de reativação para cada produto uma coisa importante aqui é que quando essa reativação ela só é permitida quando a empresa não manifestar interesse
né lá naquele período de manutenção se essa essa notificação ela foi cancelada seja pela própria empresa Que encaminhou um processo uma petição de cancelamento ou pela Anvisa não é possível né não é nem o sistema permite encaminhar essa petição de reativação de notificação tá eh um outro ponto importante que é produtos notificados dentro do período de declaração de interesse né que vai ser lá os produtos que foram notificados primeiramente de 1/10 a 31/12 de2022 eles mesmo assim a empresa né às vezes ela já até fez a a manifestação de interesse dos produtos dela ela vai
precisar fazer uma nova inclui esse produto ele acabou de ser notificado não os produtos notificados nesse período de 2029 passam a automaticamente né a ficarem ativos por mais 5 anos falando um pouco do cancelamento né então como eu falei agorinha né por solicitação da detentora ou porem correções que Tragam risco à população e mais uma vez notificações canceladas não podem ser reativadas eh alteração da notificação então qualquer alteração né que for realizada no produto e que impactar nas informações que foram notificadas que foram apresentadas paraa no processo de notificação elas precisam ser eh solicitada né
Essa alteração no produto por meio de uma petição específica que é alteração de notificação então é necessário né nesse nesse nessa petição que a empresa informe qual é a alteração que tá sendo feita né na na peticionamento naquele produto eh E caso essa alteração impacte em outros documentos né do processo então por exemplo ah eu tô alterando o prazo de validade do meu produto tô passando de 12 para 24 meses o estudo de estabilidade que eu tinha no meu processo era garantia né o prazo de validade de 12 meses se eu estou passando para 24
meses eu preciso colocar agora né um estudo de estabilidade eh que Garanta os 24 meses né então é somente os os documentos que foram impactados por essa eh alteração né o produto alterado só pode ser comercializado após essa notificação da alteração eh e a alteração da notificação não pode alterar a categoria do produto né pode alterar por exemplo de um alimento para ligação com para um suplemento alimentar por exemplo adequação às novas regras então a a norma estabeleceu alguma alguns prazos né para adequação eh dos alimentos notificados então nós temos alimentos notificados né que estavam
anteriormente eh regularizados por meio de comunicado ao órgão local e alimentos que hoje né são notificados que estão regularizados eh o registro Naisa né então Eh esses produtos né eles precisam ser notificados todos esses que foram regularizados até dia 31 de agosto de 2024 eh eles precisam ser notificados na VISA até o dia 1eo de setembro de 2025 então eles precisam ser notificados para poder manter a sua regularização a partir do momento que ele é regularizado na VISA né eh no caso do registro né o registro é Canado A Norma traz isso né que o
peticionamento do cancelamento tem que ser concomitante E no caso do comunicado esse comunicado de início de fabricação ele não é mais válido né porque a empresa tem el não pode ter uma dupla regularização daquele produto Então os produtos que eh forem fabricados a partir do dia 1eo de setembro de 2025 Eles já devem estar notificados na VISA meso que o comunicado de início de fabricação tenha sido feito antes e a gente sabe que o comunicado de fabricação fala lá que é um prazo indeterminado mas não nesse caso esse produto ele precisa ser regularizado novamente de
acordo com as novas regras eh produtos fabricados até a notificação Então até o dia que a empresa fizer a notificação na VISA tudo que ela fabricar ela pode esgotar né esse estoque de produto até o prazo de validade desses produtos né e a gente recebeu vários questionamentos em relação a esgotamento de embalagens Então hoje o que a gente tem para esgotamento de embalagem né porque assim eu tenho um produto que ele foi comunicado que a única alteração que ele vai ter que fazer na embalagem é colocar a depois que ele notificar né alimento notificado na
VISA e o número da regularização então a empresa pode fazer isso por meio de uma etiqueta né A empresa pode fazer isso por meio de uma impressão eh mas algumas empresas falam que o custo de você colocar a etiqueta e a impressão é muito alto né E que isso não seria um risco Então seria importante ter uma previsão para esgotamento de embalagens né que isso não não teve na Norma então a gente recebeu algumas informações de algumas associações né Eh pedimos novas informações né e recebemos novamente estamos avaliando e a gente também tá fazendo um
levantamento de todas as esses questionamentos que estão chegando via central de atendimento né Eh para que a gente possa avaliar né a possibilidade de conduzir um processo regulatório para alterar essa questão específica na Norma né mas pra gente conduzir um processo regulatório isso toma um tempo né e a gente precisa ter base eh e muita justificativa né para fazer a alteração da Norma go existe um um período aí né esse período de que as que algumas empresas já podem estar notificando enquanto a gente avalia essa essa questão da da alteração da Norma então a gente
orienta que caso alguma empresa tenha a necessidade de esgotamento de embalagens por essa questão essa questão simples tá de só eh alterar e inserir por exemplo o número da notificação porque se a adequação do produto né foi for feita conjuntamente com alteração de fórmula do produto alteração de de rotulagem mais específica do produto aí não tem como você esgotar você vai est colocando né num produto que que tá notificado de uma forma e a informação do rótulo vai ser outra então se for só essa questão que seja solicitado então O esgotamento conforme orientado no informe
técnico 55 de24 Tá mas a gente também eh solicita que se a empresa tiver né casos específicos né uma vez que a gente tá eh avaliando essa possibilidade de alteração da Norma que nos encaminhe também por meio do canal de atendimento que a gente tá fazendo no levantamento dessas informações para subsidiar esse processo regulatório eh a questão também deixa eu passar dos registrados né então não tem esse prazo até setembro de 2025 no caso desses produtos que eram registrados na Anvisa que passam a ser notificados eles têm até a data do vencimento do registro né
então eh a partir do momento que esse registro vem se esse produto Deixa de ser de estar regular né e a empresa não tem como mais fazer uma revalidação desse processo de registro ela precisa notificar ela também pode notificar isso a qualquer tempo né Vamos o produto ainda vai vencer daqui do anos mas ela já quer notificar agora ou porque ela vai fazer uma alteração no produto e é outra questão também porque depois da Norma vigente a empresa não pode mais fazer nenhuma alteração pós-registro porque a gente entende que se você for fazer uma alteração
pós-registro eh D é a mesma mesma questão de você notificar o produto né a a documentação já tá pronta né a a empresa vai fazer a mesma adequação que ela iria fazer para uma peticionamento pós registro ela pode fazer a notificação eh a notificação e cancelamento do produto tem quando ela faz a notificação tem que ser peticionado concomitantemente eh e os produtos fabricados durante a vigência do do registro poderão ser comercializados até o final do prazo de validade vou falar um pouquinho das notificações Então agora que a gente recebeu nesse período Então até dia 30
de novembro a VISA recebeu 334 no modificações sendo duas de alimentos com alegação 23 de alimentos de transição e cereais para alimentação infantil eh quatro de alimentos para controle de peso 19 de resina artigo precursor ou embalagem Pet PCR e 286 de suplementos alimentares aqui os nossos critérios né como a gente tem definido então a a as notificações não são avaliadas por ordem cronológica né porque elas não não precisam de uma autorização então não tem sentido você fazer por ordem cronológica eh mas a gente precisa estabelecer critérios né ou para fazer uma mostragem ou para
ter mais eficiência na avaliação né dessas notificações Então a primeira coisa que a gente fez quando dessas avaliações começaram a chegar essas notificações começaram a chegar foi a triagem no banco de dados então pelas pela própria informação que as empresas colocavam a gente conseguia ligar alguns alertas como uma designação incorreta né uma alegação não permitida um constituinte não permitido eh a partir de então a gente começou a fazer avaliação por empresa né então a empresa ela notifica a gente faz a avaliação de todos os produtos que ela notificou porque a gente percebeu que o padrão
da notificação né dentro da empresa é o mesmo Isso facilita muito a nossa análise a gente também faz avaliação das notificações porque nós recebemos denúncias né no no nosso canal de atendimento então várias denúncias foram Olha esse produto tá notificado tá como ativo mas ele tem vários problemas e a gente faz essa avaliação também e nós estamos trabalhando aí né diante agora que a gente já tem um um número de de notificações que pode nos dar né Eh dados suficientes para que a gente possa eh criar um painel para alertas né então como vez a
gente fazer isso visualmente no banco de dados né a ideia agora é a gente estabelecer critérios específicos para poder eh que o próprio banco né o próprio painel nos dê alertas para que possa avaliar né que aquele produto aquela notificação específica e ser mais efetivo né nessa avaliação então foram esses três primeiros critérios que a gente utilizou para avaliar e para chegar nos resultados né que é que eu vou falar agora então aqui é só paraa gente ter uma noção assim né do das empresas né do quantitativo de empresas que notificar nesse período então no
total foram 94 empresas que fizeram notificação na VISA eh dessas 64 a gente conseguiu avaliar pelo menos uma notificação um produto né dessa dessas empresas então 70% das empresas foram avaliadas duas empresas que peticionaram alimentos com alegação Então essas duas foram avaliadas eh cinco que peticionaram alimentos de transição então das cinco duas foram avaliadas alimento para controle de peso foi só uma empresa né E ela também foi teve uma pelo menos uma notificação avaliada eh resina artigo precursor ou embalagem Pet PCR foram 10 empresas e nós avaliamos seis e suplementos alimentares foram 78 empresas e
nós avaliamos 53 aqui eu tô falando só de empresas tá não tô falando de quantitativo de notificações Agora eu vou começar falar um pouquinho desses desse quantitativo então avaliação de alimentos com alegação de propriedade funcional de saúde lá naquele gráfico anterior eu disse que foram recebidas duas eh nós avaliamos as duas né então 100% delas foram avaliadas e como resultado a gente teve um cancelamento e uma solicitação de correção eh o motivo do cancelamento quando a gente tá falando de alim com alegação né é um alimento convencional que possui uma alegação autorizada né Essas alegações
elas precisam ser autorizadas eh para o ingrediente né do produto ou para o produto né então eh tem uma lista lá de alegações autorizadas só que o produto ele também precisa atender o requisito técnico daquela categoria então por exemplo ele é um bolo ele precisa atender o requisito do bolo se ele é um gelado comestível ele precisa atender o requisito do gelado comestivel Então nesse caso específico o produto ele não atendia né Eh os requisitos da categoria que ele que ele está enquadrado né Além disso o produto se apresentava como alimento com alegação mas ele
er ele tinha uma forma farmacêutica então ele seria enquadrado como suplemento e não como um alimento com alegação eh uso de alegação não aprovada para nenhum constituinte então por exemplo eh produto tinha uma alegação de fibra mas nemhum dos constituintes do produto tinha fibra né então ele não não podia usar aquela alegação eh ausência de estudo para determinação de prazo de validade a licença sanitária vencida e o uso de de marcas que induzem o consumidor a erro ou engano em relação a atributos que o produto não possui ou que não podem ser demonstradas então Esses
foram os motivos de cancelamento de alimentos com alegação um outro produto eh foi solicitada uma correção então a empresa ela entrou com essa com esse assunto de petição mas ela apresentou toda a documentação Inclusive a designação do produto como um suplemento alimentar então a gente avaliou esse produto como suplemento alimentar né verificou que a única única questão desse produto era eh o assunto que tinha sido peticionado errado a gente fez a alteração do assunto nós mesmos fizemos aqui e mandamos um ofício paraa empresa dizendo que essa correção foi feita n e que agora o produto
dela não era mais notificado como alimentos para negação e sim como suplemento alimentar avaliação da notificação de alimentos de transição e cereais então nós conseguimos avaliar 60% né da das notificações dessa categoria que chegaram eh 90% das que nós avaliamos eh foram canceladas e 10% estava ok né das que nós avaliamos e não de todas que a gente recebeu né então dentro desse 60% então motivo de cancelamento não atendimento aos requisitos da categoria então para alimentos para transição a norma Ela traz alguns limites né que alguns critérios que a que o produto precisa atender de
matéria sólida PH e nitrata então Eh alguns produtos né não não atendiam a esses critérios na Norma eh e outros produtos também a encaminharam um estudo de determinação de prazo de validade não concluído então só um estudo Inicial né dizendo que tava iniciando o estudo e mesmo esse estudo Inicial ele tinha resultados que indicavam que o produto não era seguro porque ele não atendia aos parâmetros especificações microbiológicas e também de deterioração do produto então então Foi estabelecido né eh risco à saúde e eles foram cancel lados eh avaliação de notificações de alimentos para controle de
peso nós recebemos quatro né Eh 50% foram avaliadas e as duas que foram avaliadas foram canceladas Então os motivos foi a ausência de relatório de estudo de estabilidade A empresa ela apresentou apenas uma descrição das análises que seriam realizadas e conclui pelo prazo de validade então a gente não a gente precisa saber também dos resultados dos parâmetros né que foram estabelecidos eh mas eu vou falar um pouquinho mais de estudo de estabilidade mais para frente e a ausência de Lauda e certificado de análise O Memorial de cálculo do produto que comprove atendimento aos requisitos de
composição estabelecidos pela 715 que é a norma que trata de alimentos para controle de peso então o documento que a empresa apresentou ela simplesmente descrevia a faixa de especificação dos nutrientes né não tinha nenhum nenhum Memorial de cálculo ali dentro avaliação de notificações de resina é tipo precursor ou embalagem final de pet PCR grau alimentício então nós avaliamos 70% das das notificações que chegaram 80% estavam em conformidade eh 10% cancelada e 10% com correção então o motivo de cancelamento foi que era um artigo precursor e a empresa utilizava uma resina que não estava aprovada pros
tipos de alimentos declarados na notificação então o artigo precursor era para um tipo de alimento e a resina aprovada era para outro tipo né E também ausência de laudos que comprovem os limites de migração em todos os tipos de alimentos escolhidos e sem justificativa baseada em racional técnico científico com relação às correções né Eh diferentes proporções de resina Virgin reciclada não devem ser consideradas diferentes apresentações Então nesse caso né A empresa ela mandou várias apresentações porque ela variava a a proporção de resina virgem e resina reciclada Então nesse caso não é uma diferente apresentação né
A empresa ela só precisa colocar eh o critério mais crítico vamos dizer assim né que é colocar a apresentação né a apresentação dela lá com maior proporção de resina reciclada ela não precisa fazer várias apresentações destrinchar isso dentro do processo e também eh uma solicitação para corrigir aditivos corantes e pigmentos né que eles devem ser preenchidos na fórmula do produto e aí caso a empresa tá preenchendo lá e ela não não encontre aquele produto né não encontre aquele aditivo aquele corante ela na nas substâncias lá cadastradas ela pode colocar clicar na opção outros e aí
ela descreve o nome do aditivo e o seu código a gente viu também que algumas empresas estavam descrevendo só o código né então eh a gente precisa do o nome do aditivo e também do do código né Eu dei um exemplo aqui pigmento azul e aí na frente o código e avaliação de suplementos alimentares então nós avaliamos 70% das notificações que a gente recebeu nesse período os resultados 70% foram canceladas eh 20% estavam ok e 10% precisaram de correção então motivos de cancelamento ausência de documentação obrigatória nos termos da in 281 então a empresa ou
não tinha licenciamento válido eh ou não apresentou estudo de estabilidade ou não apresentou laudo Memorial de cálculo eh às vezes em alguns casos as empresas não apresentaram nenhum documento né Aram eh papéis em branco né arquivos em branco então esse também foi o motivo da ausência né então a ausência de qualquer um desses documentos eh cancelamento porque a gente entende que que esses três documentos eles comprovam a segurança qualidade e os requisitos técnicos do produto né E se você não tem um desses documentos não tem porque a gente corrigir né então o um licenciamento não
vai ser dado eh a empresa tá fabricando sem licenciamento o estudo de estabilidade não pode ser conduzido né quando o produto já tá no mercado e o o laudo do produto ele precisa ter minimamente para saber o que que aquele produto né Eh tem né que tem e se realmente atende a a legislação Outro ponto foi constituintes não permitidos então quando faz-se o cadastro no sistema de notificação eh Cada vez que a empresa escolhe né coloca lá o constituinte e coloca ingrediente ela precisa dizer do que aquele ingrediente é fonte e colocar a quantidade daquele
nutriente né daquela nutriente fonte que ele tá declarando o próprio sistema ele faz o cálculo e se aquele limite tiver acima ou abaixo do permitido na Norma essa notificação não acontece da mesma forma se se a empresa utiliza um constituinte no no produto que não está autorizado esse constituinte também não aparece para ser inserido no eh no formulário então algumas empresas elas possuíam esses constituintes Não permitidos elas declararam no formulário e colocaram esse constituinte como artigo sexto né então assim esse essa questão eh claramente né se não era um um um ingrediente do artigo sexto
Então por esse motivo também houve cancelamentos também por conta dessas quantidades dessas substâncias né diferentes dos limites estabelecidos estudos de estabilidade que não comprovam a manutenção das características do produto durante seu prazo de vida útil eh e o Lau do certificado de análise ou Memorial de cálculo incompleto ou divergente da formulação apresentada no formulário eletrônico então a empresa apresenta uma formulação lá no formulário eletrônico e o laudo que ela apresenta é de um produto completamente diferente daquele produto que tá notificado ou ainda o próprio laudo diz que ele tem eh constituintes não autorizados e que
não foram declarados no formulário Então são esses os pontos mais críticos né que levaram ao cancelamento desses 70% de notificações para correções então Eh tinha dito que eu ia dar alguns exemplos de correções que a Anvisa mesmo pode fazer né e da ciência pra empresa e outras que a gente solicita que seja eh feita pela empresa e a gente dá um prazo né para que seja feita essa correção por meio de uma alteração da notificação a gente diz ó a empresa você entra lá com uma alteração da notificação e corrige esse esse esse ponto então
designação em des acordo com a RDC 243 de 2018 então a designação eh de o suplemento alimentar Ela é bem fechada em relação ao que pode ser colocado né então Obrigatoriamente tem que ter suplemento alimentar no nome do produto e tem que ter é a forma farmacêutica que ele é apresentado suplemento alimentar em cápsulas isso é padrão né suplemento alimentar em solução oral e aí a empresa pode colocar né do que aquele suplemento eh fonte né ou de ou nome de constituintes do do produto então suplemento alimentar de creatina em pó né mas não colocar
só creatina né não colocar só creatina 3 G não colocar eh creatina Sabor Morango né então tem que se atentar à designação estabelecida pela 243 se o se a a a notificação tiver com a documentação Ok e esse questão da designação foi o único problema do produto a gente vai solicitar que a empresa corrija nesse caso a gente não pode né Eh corrigir pela empresa porque é a empresa que vai definir como que ela quer que seja designado dentro dentro dessas possibilidades que eu falei né Eh marcas irregulares então a empresa ela notifica 30 marcas
e a gente identifica que sei lá cinco marcas estão irregulares né Elas eh tem essa questão de de atribuir ao produto eh atributos que ele não tem né que ele não possui então a gente mesmo Tira essas marcas da notificação E aí a gente dá ciência paraa empresa de que essas marcas estão irregulares não podem ser utilizadas no produto e foram retiradas eh do processo de notificação eh alegação não permitida para nenhum dos constituintes do produto então por exemplo Só existe esse esse problema também tá porque geralmente esses problemas eles Vê com outros né mas
vamos supor né empresa ela colocou como o exemplo que eu dei anteriormente ela colocou alegação de fibra num produto que não tem fibra mas esse foi o único erro que ela cometeu né então assim ela pode não usar essa alegação então a gente também retira essa alegação do produto e informa que ela não pode usar essa alegação eh classificação incorreta de aditivos com Advance de tecnologia ingredientes do artigo sexto isso acontece muito né quando a empresa vai cadastrar lá o o constituinte que é um aditivo às vezes ela coloca que é artigo sexto mas é
um aditivo às vezes ela coloca que é cante de tecnologia mas é aditivo às vezes é cante de tecnologia coloca um aditivo E aí esse tipo de correção né pontual a gente também pede para que para que a empresa fa né as correções é lista de ingredientes em desacordo com RDC 727 Então o que a gente vê muito a lista de ingredientes é a lista de ingredientes que que tá no rótulo do produto n que tem que ser preenchida no formulário e as listas geralmente não estão né conforme a RDC 727 Então a gente tem
avaliado isso e pede então paraa empresa colocar de acordo com a RDC ausência de declaração de componentes da cápsula e também de ingredientes compostos a gente tem que lembrar que o formulário ele não é só para dizer os constituintes eh do produto que é fonte ou de algum nutriente né Eu preciso saber de tudo que tá ali dentro do produto e faz parte do produto a cápsula né então se o produto tem uma cápsula que é composta de gelatina e mais dois eh corantes precisa est discriminado dentro do formulário né quanto de gelatina tem né
naquela naquela proporção né na porção que tá sendo colocada eh os corantes que estão sendo utilizados e a mesma coisa para ingredientes compostos né a gente precisa saber o que que tem dentro desses ingredientes que eles fazem parte do produto também então é a formulação mesmo do produto e o que tem muito é a ausência de informações sobre aromatizantes e corantes então o preenchimento do formulário tá muito assim aromatizante tanto mas eu não sei que aromatizante que é aqu né na na fómula tudo bem que lá na lista de ingredientes não é obrigado a colocar
Qual é o aromatizante mas aqui na formulação a gente precisa saber né Eh corante é a mesma coisa então sempre dá todas as informações eh sobre Quais são esses esses aditivos que estão sendo incluídos aí orientação específica vou passar aqui alguns pontos eu já até falei mas não custa reforçar que é o que a gente mais vê de erros né então como eu já falei a designação do produto não só para suplemento tá todo o regulamento técnico tem eh da categoria de alimentos tem para que é que que o produto tá sendo eh como que
ele deve ser designado né então importante não incluir nessa designação sabor nome comercial marca alegação quantidade de ingrediente nem nome de empresa designação é designação legal é o que tá estabelecido na eh resolução e que é o que vai eh caracterizar né O que é o que vai designar a categoria daquele produto identificar aquele produto por sua categoria eh marcas não utilizar marcas que induzem o consumidor a erro ou engano em relação a atributos que o produto não possui ou que não podem ser demonstradas e também inserir cada marca em uma linha específica né então
cada uma das marcas para que a gente possa entender que aquilo são marcas diferentes e não continuações né não dá dá impressão de que não sei né não dá nem para entender Qual qual é a marca que tá sendo solicitada para aquele produto alegações utilizar apenas as alegações para os constituintes presentes no produto e apenas as que serão utilizadas na rotulagem do produto são duas coisas aquela questão de você colocar uma alação de fibra num produto que não tem fibra não pode e apesar do sistema permitir que você coloque não pode colocar e eh utilizar
eu tenho cinco alegações diferentes para vitamina C Mas eu só vou usar uma Então eu só vou colocar na minha notificação a que eu vou realmente utilizar na rotulagem né não preciso colocar assim eh período de validade preencher com prazo de validade do produto determinado nos estudos de estabilidade a gente vê muito aqui o formulário tá preenchido com um prazo de validade o estudo de estabilidade tem outro prazo de validade né chegou à conclusão de outro prazo de validade então é sempre se atentar a a questão o estudo de estabilidade ele tem que garantir o
prazo de validade sugerido no formulário de notificação e ainda aqui um ponto que são os cuidados de conservação né a gente tem recebido muitas notificações em que não descreve os cuidados de conservação do produto na no formulário né a empresa coloca assim de acordo com o estabelecido no rótulo mas se fosse para colocar assim a gente não tava pedindo aquela informação no formulário né então a gente tá pedindo aquela informação no formulário porque esses cuidados de conservação tem tudo a ver com o estabelecimento de prazo de validade do produto então é sim Necessário colocar essa
informação no formulário de notificação no campo específico a questão do grupo pop ional indicado né que precisa estabelecer para suplementos alimentares quais são os grupos né que são indicados aquele aquele produto eh exclusivamente né paraa categoria de suplementos alimentares como eu falei a gente tem essa validação eh da Porção diária com relação à quantidade de nutrientes então Existem várias dúvidas com relação a preenchimento desses dois Campos né indicação de uso e quantidade de proporção a gente já tá tentando fazer uma melhoria no sistema para que isso fique mais claro né mas até então até que
essa melhoria não não seja feita né E que as pessoas precisam continuar notificando a gente deixou uma orientação lá no manual do solicita especificamente para esse assunto e eu só vou repetir aqui o que tá lá no manual e dá alguns exemplos tá então paraa categoria de suplementos alimentares também será exibido o campo indicação de uso quantidade porção porções para preenchimento obrigatório este Campo deve ser preenchido com um número inteiro que represente a quantidade indicada para a utilização por dia para o grupo populacional correspondente então se eu coloco um grupo populacional de quatro a oito
né eu vou dizer qual é a porção que aquele eh grupo tá tá indicado para aquele grupo e lá na minha formulação eu vou colocar a quantidade por porção do nutriente Quando eu for que é o próximo passo aqui então quantidade proporção deve se atentar que para o preenchimento do campo quantidade proporção visto que ele está intimamente relacionado ao valor preenchido no campo indicação de uso e representa um valor unitário o valor inserido no campo quantidade por porção deve corresponder à quantidade de nutriente presente em uma unidade de valor ido no campo indicação de uso
para ficar mais claro eu coloquei alguns exemplos por exemplo suplemento alimentar em pó a indicação de uso l no campo indicação de uso é um sachê para o grupo populacional de crianças de 9 a 18 anos e dois sachês para adultos por dia lá no campo indicação de uso deve ser preenchido com um número um de um sachê pro grupos de 9 a 18 e dois dois CS para o grupo populacional adultos e no campo quantidade por porção lá na fórmula a empresa vai preencher com a quantidade de nutriente presente em um sachê no caso
de suplemento alimentar em cápsulas indicação de uso três cápsulas para adulto por dia Campo indicação de uso quantidade por porção deve ser preenchido com o número TRS Campo quantidade por porção deve ser preenchido com a quantidade de nutriente presente em uma cápsula então a indicação de uso são três cápsulas mas lá quando você vai colocar a fórmula você vai colocar a quantidade em uma cápsula por quê Porque o sistema Vai Multiplicar o valor lá que foi colocado de quantidade em uma cápsula por TR que é o número de porções para poder dar o o cálculo
final suplemento alimentar líquido indicação de uso 5 ml pro grupo populacional de crianças de 4 a 8 e 20 ml para adultos por dia eh Campo indicação de uso deve ser preenchido com número C pro grupo de crianças e com o número 20 pro grupo de adultos e lá na na formulação a quantidade por porção deve ser preenchida a quantidade de nutriente presente em 1 ml porque o sistema também vai fazer a conta pro grupo de crianças vezes c e pro grupo de adultos vezes 20 para poder fazer essa validação como eu disse a gente
tá tentando deixar isso um pouco mais fácil né e assim que a gente fizer essa alteração no sistema a gente vai divulgar aí a notícia né O que é que foi feito e e uma e encaminhar as orientações da nova forma de preenchimento mas por enquanto na vai mudar e precisa ser feito dessa forma eh orientações sobre preenchimento do formulá de notificação aqui a componentes da Fórmula então o nome de constituinte do ingrediente esse composto tem que ser o mesmo utilizado na lista de ingredientes tá eh a gente tem visto vários várias eh notificações que
por exemplo tem um lá na lista de de ingredientes tem um constituinte fonte de zinco por exemplo que ele não tá aprovado na in 28 A empresa Coloca outro constituinte né porque ela deve abrir lá não achar o o dela E aí ela coloca outro formulário então diferente da lista de ingredientes então eh não é possível né aí esse esse produto ele não tá aprovado então ele vai ser cancelado né a notificação colocar na função né ingrediente se é ingrediente aditivo qu adante de tecnologia e para suplementos alimentares a gente inclui outros artigo sexto eh
para suplementos alimentares é obrigatória a inclusão da informação sobre fonte e quantidade proporção quando dentro do ingrediente tem um um ingrediente específico em suplemento líquido que é água né a gente não tinha eh quando o sistema foi lançado né a gente não tinha fonte de água né Então as empresas ficavam com dúvida de como eh declarar a água então algumas declararam como aditivo outras como outros ingredientes do artigo sex mas agora a gente já atualizou o sistema e tem fonte de água então a empresa F escolhe água fonte de água quem já notificou né como
artigo sexto ou como aditivo não tem problema né conforme for necessário fazer a alteração dessas notificações a própria empresa pode ir lá e fazer esse ajuste ou se a a Anvisa avariar e Verê que tem alguma outra correção a gente mesmo pode fazer essa correção só da ciência para pra empresa tá eh as listas de ingredientes mais uma vez ela tem que tá conforme a 727 e é exatamente a lista que tá no rótulo do produto outras informações no sistema então por exemplo eh a gente recebe muita demanda no site né no na central de
atendimento dizendo ahha não consegui identificar a inclusão a o material de embalagem né Então realmente pode ser que não tenham todas as informações necessárias né para materiais de embalagem forma de apresentação às vezes alegação né eh qualquer divergência Que que foi encontrada né no sistema a gente pede para que vocês informem por meio do canal de atendimento Fale Conosco então informe se for possível mand a tela de erro né se deu algum erro se tá faltando alguma informação que a gente que é o nosso canal de comunicação com você a gente responde por lá aí
os outros documentos né Falei dos formul do formulário e agora vou falar um pouco dos outros documentos então a licença sanitária né ela sempre tem que tá válida tá eh tá presente né E tá válida relatório de estudo de estabilidade que Garanta o prazo de validade declarado o laud do certificado de análise Memorial de cálculo E tem também um documento com informações do cadastro de fabricante internacional esse documento até então ele tava como obrigatório mas ele é um é um documento que ele é aplicável só quando existe o fabricante internacional não não cadastrado né quando
aquele produto tem um fabricante Internacional e ele ainda não tá cadastrado no sistema Então a gente vai pedir para que seja retirada a obrigatoriedade desse documento né então ele vai aparecer lá mas não é obrigado a colocar essa informação eh se a empresa não tem essa essa necessidade né ou não tem um fabricante internacional ou não tem nenhum fabricante internacional que ainda não tá cadastrado então a gente para ficar mais fácil porque senão a empresa tem que entrar e colocar um um anexar um documento de não aplica relatório de estudo de estabilidade então assim esse
é um ponto que disparadamente é um dos diríamos que é o principal ponto de cancelamento né de notificações eh a gente fez uma revisão no guia 16 e a gente abriu esse guia para contribuições de novo algumas questões a gente Já identificou que seria importante colocar no guia uma delas é as informações mínimas que precisa ter um relatório de estudo de estabilidade aqui eu tô falando muito de suplementos alimentares tá que Suplementos o guia ele trata de todos os outros Alimentos mas o o nosso maior ponto aqui de de cancelamento talvez pelo volume de de
notificações né E isso aqui se enquadra também eh sobre alimentos para controle de peso né que também precisa entregar né um um nutriente e e e garantir isso né para quem pro consumidor que tá consumindo Então a gente tem aqui uns a gente fez internamente um eh um resumo assim né das informações que precisa ter no relatório aí a gente vai colocar isso depois e no ano que vem quando a gente fizer a outra revisão do guia então o o relatório ele tem que ter nome endereço da empresa que é responsável pela execução daquele estudo
eh ele tem que ter o nome do produto e quanto de produto tem numa embalagem do produto o tipo tamanho e composição de cada embalagem E se ele tem algum sistema de fechamento informação de que o alimento está sendo testado em embalagem equivalente e sistema de fechamento também equivalente Nos quais será comercializado eh formulação do produto número tamanho e data de fabricação dos lotes que foram testados né naquele estudo data de início do estudo tamanho da amostra e intervalos de teste por exemplo frequência de teste de amostra para cada tributo condições de armazenamento das amostras
mantidas para teste os parâmetros né que Quais são os estudos que vão ser feitos ali os critérios de aceitação e também se né tiverem valores críticos eh uso de métodos de teste confiáveis significativos e específico pro que tá sendo testado método de avaliação dos dados incluindo qualquer análise estatística utilizada para estabelecer a validade do produto os resultados desses estudos e a conclusão muitos os de estudos de estabilidade vem sem resultados apenas dizendo conforme conforme conforme E assim a gente não sabe o que é conforme a gente não tem nenhum parâmetro estabelecido para saber o que
que é conforme Então essas informações a gente entende que se tiver essas informações já ajuda Talvez as próprias empresas a construir esse relatório de forma que que possa minimizar esses cancelamentos mais questões de estudo de estabilidade que a gente queria colocar eh a gente recebe muitas muitos questionamentos sobre estudos de estabilidade dizendo que se a anvis Aceita esse tipo de estudo anvis aceita aquele outro tipo de estudo porque o meu produto porque eu não sei o qu e o que a gente tem a gente não tem uma Norma específica que trata nãoa existe uma receita
de bolo para Su estabilidade de alimentos que é o mundo então a gente fez um guia né E lá no guia tem algumas árvores decisórias tem algumas orientações de como para cada tipo de alimento conforme eh os ingredientes e a matriz daquele alimento você precisa fazer eh testes né então a gente não tem como responder paraas empresas por meio do s do canal de atendimento se vai ser aceito ou se não vai ser aceito né Eu acho que vai a empresa ela tem que conhecer o produto dela que é o primeiro primeiro item lá do
do guia de estabilidade né preciso saber do que o meu produto é constituído Quais são os aditivos que eu coloco nesse produto Qual é a embalagem como que ele vai ser conservado O que que tá interferindo né qual se os os ingredientes t e e interação entre eles Qual é a porcentagem de degradação Existem muitos estudos científicos aí né que falam de alguns constituintes como que ele degrada então assim e existe a possibilidade de você ter um racional mas a empresa tem que mandar pra gente Esse racional ela tem que dizer olha eu consigo fazer
um estudo acelerado porque eu sei que a taxa de degradação da vitamina C por meio dos estudos Tais Tais e Tais é essa né então eu consegui medir aqui a vitamina C no início e no final conseguir manter existe vários cálculos estatísticos vários modelos estatísticos que precisam ser aplicados para você extrapolar um prazo de validade de um estudo acelerado E isso tem que ser demonstrado porque não adianta falar que eu fiz um estudo de acelerado de 6 meses e eu quero 24 eu apresento o resultado de um estudo de 6 meses não faço nenhum racional
para aquilo e falo para Visa que o meu produto Vale 24 não tem como aceitar né não tem como garantir que aquele produto Vale 24 Então acho que a gente tá tá tentando ano né a gente sabe que algumas empresas T algumas dificuldades a gente tá fazendo um curso agora que vai ser disponibilizado no ambiente de aprendizagem da Anvisa que vai est disponível para todo mundo que vai falar sobre o guia né que é como a aplicação do guia eh para determinação de prazo de validade a gente fala muito em suplementos alimentares mas outros produtos
também às vezes diferente de suplemento alimentar né Eh a a abordagem do do estudo de determinação de prazo de validade é diferente mas precisa ser ser feito minimamente né Eh a gente queria dizer que o guia tá aberto para contribuições até dia 30 de dezembro esses questionamentos que a gente recebe eh do tipo Olha eu tenho um estudo eh que garante né que fazendo que já já eh uma evidência né técnica científica que garante que se eu fizer o estudo dessa forma para esse produto né para esse constituinte eu consigo extrapolar o prazo de validade
Então tudo isso é importante que seja colocado também nas contribuições do guia né porque a gente também pode atualizar o guia no sentido de prever orientações né prever outras orientações além das que já estão lá eh Outro ponto important de estudo de estabilidade que acontece muito é que o limite de aceitação dos estudos de estabilidade Eles são diferentes do limite de aceitação da informação nutricional quando a gente tá falando do estudo de estabilidade a gente tem eh métodos né que são aplicados para definição né daquele te daquele nutriente o próprio método ele tem a sua
variabil né o próprio estudo ele vai dar Qual é a faixa permitida para aquele método n Existem várias várias limites ali de a depender do nutriente que tá sendo analisado né pode ser fechado 80 120 que isso não é limite de especificação né Isso é o o limite lá da da da fiscaliza né da da rotulagem nutricional não é aplicável para o estudo de estabilidade o estudo de estabilidade cada método vai ter a sua variação vai ter que ser estabelecido ali para aquele nutriente específico Quanto é aceitável dentro daqui né esse Quanto é aceitável ainda
tem um plus né no caso de suplemento alimentar porque a gente tem que lembrar que suplemento alimentar ele tem um limite mínimo limite máximo na n28 que tem que ser atendido então quando eu tô estabelecendo esse limite Eu também preciso ver se o Meu Alvo não tá muito próximo do limite mínimo ou muito próximo do limite máximo para que eu não possa sobroso ter um prazo de validade muito alto porque senão eu não vou atingir o limite mínimo em alguns nutrientes até o final do prazo de validade então algum algumas questões assim né que que
a gente que queria colocar que a gente vê que acontece muito eh marcadores né muitos estudos acelerados com marcadores então por exemplo a empresa ela tem um polivitamínico minerais né suplemento alimentar de vitaminas e minerais Então ela tem várias vitaminas vários minerais ela faz um estudo acelerado e escolhe como marcador de início fim um mineral estável então assim existem vários outros constituintes ali que são muito menos estáveis do que aquele mineral e que precisam ser avaliados né E ela Escolhe um que não vai dar a a garantia da estabilidade para aquele para aquele produto né
e ainda mesmo os marcadores a gente tenta colocar colar isso nos pareceres mesmo os marcadores eles são válidos para os tempos intermediários né Para eu para que eu possa garantir e fazer a extrapolação desses dados de se meses utilizando modelo estatístico para 12 ou para 24 depend do que eu tô fazendo eu preciso ter os valores né dos meus eh de todos os meus nutrientes no Inicial e no final então eh o curso Ele traz muito isso tá a a a aplicação do guia porque tudo isso tá no guia mas mas não é isso que
a gente tá vendo na na realidade Então eu acho que era isso sim de uma forma bem geral a gente espera né que que esse curso ajude né auxilie que a gente melhore né falando aqui algumas coisas que também melhore ou a apresentação desses estudos eh a gente tem visto tá empresas que encaminham O mesmo texto de estudo e só muda o nome do produto eh outras que a gente cancela ela dizendo uma coisa ela retorna no outro dia a notificação exatamente corrigindo aquele ponto que a gente falou né que não é impossível fazer isso
no estudo de estabilidade então esses pontos né a gente tá levando em consideração e é o realmente o que a gente entende que era o objetivo da Norma né que é a gente poder identificar questões críticas nesses produtos que até então a gente tinha pouco conhecimento porque a gente não tinha conhecimento mesmo desses produtos na Anvisa para poder planejar As Nossas ações de fiscalização Então essas notificações apesar da gente ainda considerar muito poucas né diante do do mundo de suplementos alimentares que a gente tem já tá conseguindo pautar as nossas atividades de fiscalização pro próximo
ano né então assim é importante dizer que eh O que é declarado num relatório de estabilidade ele tem que ser comprovado uma documentação que a empresa tem que ter com ela né Por laudos eh os dados brutos então não É só escrever um relatório né tudo aquilo tem que ter comprovação a gente não tá pedindo que envie toda essa comprovação a empresa tá declarando que ela tem aquilo e que ela fez aquilo então a gente numa eventual fiscalização a gente vai avaliar exatamente o que foi realizado n naquele relatório Então acho que de estudo de
estabilidade era isso e eh por último aqui eu vou falar um pouco dos laudos né Essa questão de laudo certificado de análise Memorial de cálculo eh também é muito crítico né a gente quando a gente tava escrevendo a norma quando ela foi paraa consulta pública a gente tinha deixado só lá o de certificado de análise e aí na na consulta pública vieram várias contribuições no sentido de que muitas vezes as empresas e eu tô falando principalmente mais uma vez né para suplementos eh elas fazem o estudo de estabilidade então elas já teriam um laudo do
produto né em tempo Inicial né então não não precisaria eh encaminhar um novo laudo que seriam os mesmos os mesmos eh o mesmo documento e queem Então seria importante trazer também Talvez para esses produtos né O Memorial de cálculo eh o laudo ele é o comprovante né O que comprova que aquela que aquele produto atende os requisitos de composição né então O Memorial de cálculo sem um laudo mesmo que seja lá do estudo de estabilidade que era o que a gente alterou para para poder aceitar tá ele não nos diz muita coisa né Eh e
E ainda por cima o que a gente vem recebendo de Memorial de cálculo é uma lista da formulação do produto só que a formulação do produto a gente já tem tá lá no formulário de notificação exatamente a formulação né então no O Memorial de cálculo né Principalmente ele é importante muito para alimentos de transição por exemplo né Porque daí você vai ter vários os ingredientes ali você não vai ter nutriente específico para avaliar você vai saber o que tá vindo de fonte de proteína de carboidrato de valor energético né dos ingredientes que isso é importante
paraa análise da eh do alimento então esse cálculo ele tem que ser feito para para dizer assim ó o que cada um dos meus ingredientes do produto fornece pro produt produto de nutriente seja macronutriente seja micronutriente né a depender do que eu quero que o meu que o meu produto é entregue né que L Garanta Então esse é o objetivo do memorial de cálculo dizer como que é que chegou até ali né E dizer exatamente o que é que cada cada constituinte ali cada matériaprima contribui pro valor nutricional do produto mas isso é muito diferente
de um certificado de análise quando a gente tá falando de um suplemento alimentar né que a gente precisa saber se realmente ele tá Cumprindo com os limites né se ele mantém se Ele misturou lá tudo e ele mantém realmente aquela aquela composição eh a gente pretende colocar alguma questão de Memorial de cálculo no lá no perguntas e respostas para tentar fazer um modelo para melhorar a entrega desse desse documento eh e por fim aqui as alterações de notificação então é um um documento com a descrição né que eu já até tinha falado que o documento
com a descrição das alterações realizadas sempre tem que estar presente acompanhado apenas dos documentos impactados pela alteração o sistema atualmente quando a empresa ela entra com uma alteração de notificação todos os documentos ficam obrigatórios E aí a gente vai deixar obrigatório só o documento com a descrição das alterações e todos os outros quando aplicaram porque eles só precisam ser né colocados de novo se teve alguma alteração na naquela notificação eh bom era isso né que eu tinha aqui para para falar com vocês hoje sobre aqui os nossos primeiros resultados dessas avaliações de notificações tentar dar
dá alguma orientação né dá alguma luz e dizer que a gente tá atento ao canal de atendimento né central de atendimento para responder mas Além disso eh Nós também temos muito material no nosso site a gente fez atualização eh das informações do site fez a fez a o painel de perguntas e respostas para regularização os outros webinares que tiveram que tiveram perguntas e respostas de webinar também eh tem documentos lá com muitas perguntas que foram feitas em webinares eh a própria leitura das normas é muito importante né a gente às vezes recebe questionamento é do
tipo ah eu fiquei sabendo que agora eu eu preciso notificar suplemento alimentar Não não é fiquei sabendo a empresa ela tem que entender da Norma um outro ponto importante de suplemento que a gente recebeu Várias Vários questionamentos né que eu queria esclarecer é que o estudo de estabilidade ele não é uma coisa nova que quem estabeleceu ele foi a a RDC 843 os estudos de estabilidade estão na RDC 243 Né desde 2018 então Aqueles mesmo aqueles produtos que tiveram que ser adequados a 243 a adequação deles finalizou em 2023 então todos os suplementos alimentares que
hoje estão no mercado eles precisam estar de acordo com a 243 e eles precisam ter minimamente um estudo que determine seu PR de validade eh a a gente precisa saber né que aquele produto Tá entregando o que ele diz que ele tá entregando Então a gente tem várias questões de suplemento né Por que que a gente estabelece tanta coisa na VISA né especificação que tem que ser eh garantida né e limite mínimo e limite máximo isso não é só para est escrito na Norma né isso que pro produto ele precisa atender né então eu acho
que não é uma novidade tá a gente não entende por isso que a gente deu um prazo de um ano né para para essa notificação desses produtos que estavam no mercado porque a gente sempre entendeu que isso não é uma novidade então dizer que foi a a 843 que trouxe essa necessidade isso não é né a gente sabe que todos esses produtos se eles não têm o mínimo de determinação do prazo de validade declarado eles estão irregulares Então é isso eu acho que o que a gente queria né com a notificação a gente tá conseguindo
a gente tá conseguindo avaliar a gente tem previsão de de o próximo ano conseguir dar um gás para avaliar mais notificações eh não só no sentido de cancelar mas no no sentido de orientar e se tiver outros pontos que a gente acha necessário vir aqui falar e orientar para que as empresas possam trazer né uma notificação eh mais adequada a gente continua aqui com esse canal fazendo essas esses webinares tá E aí Espero que em janeiro eh todos possam aproveitar e e entrar né no no nosso curso lá de estabilidade a gente vai divulgar também
por meio de notícia o link para que todos possam fazer OK obrigada obrigada pela atenção boa tarde a todos webinar encerrado
Related Videos

2:32:16
Webinar - Segurança do Paciente nos serviç...
Agência Nacional de Vigilância Sanitária
297 views
1:38:49
Webinar - Novas regras para regularização ...
Agência Nacional de Vigilância Sanitária
3,790 views

11:48
'My jaw is dropped': Canadian official's i...
CNN
1,400,972 views

24/7 Lofi Study Beats 📚 Deep Focus & Work...
Velmez

1:58:38
Reunião com as Visas - Eventos Adversos co...
Agência Nacional de Vigilância Sanitária
222 views

25:25
140 SHOCKING Train Collisions & Mistakes C...
Brake Point - Idiots In Cars
82,239 views

4:03:44
Ibiza Summer Mix 2024 💎 Best Of Tropical ...
Deep Diamond
6,599,869 views

1:08:42
Importância da Notificação de EA e QT de d...
Webinar Anvisa
295 views

3:20:30
Audiência pública para discussão e atualiz...
Agência Nacional de Vigilância Sanitária
790 views

57:44
Webinar - Explorando Tópicos do Edital de ...
Agência Nacional de Vigilância Sanitária
193 views

21:01
Watch Trudeau speak directly to Trump duri...
CNN
11,423,781 views

2:48:16
Seminário CADIFA 2024 - Parte da Tarde
Agência Nacional de Vigilância Sanitária
309 views

58:09
Atualizações da RDC nº 945 de Pesquisa Clí...
Inovatie Serviços em Saúde
175 views

3:03:44
Elton John, Lionel Richie, Bee Gees, Phil ...
Soft Rock Playlist
1,904,669 views

20:25
Como reativar sua farmácia no SNGPC | É de...
Ascoferj – O Canal da Farmácia
16,073 views

25:59
Lawrence: Canada's Trudeau humiliates 'cow...
MSNBC
4,418,199 views

2:43:51
The Insulin & Glucose Doctor: This Will St...
The Diary Of A CEO
2,687,662 views

50:16
Notificação de materiais de uso em sáde
Webinar Anvisa
1,076 views

58:42
Перевооружение Европы. Историческая речь М...
Настоящее Время
93,660 views

15:58
Republicans Slobber Over Trump Address, He...
Jimmy Kimmel Live
2,270,554 views