CÉLULAS DE COMBUSTÍVEL: O que são e Aplicações | Eletroquímica | Aula 17
44.27k views2167 WordsCopy TextShare

Professor Igor Química
Saiba tudo sobre as células de combustível
As células de combustível ou pilhas de combustível são di...
Video Transcript:
o calor liberado pela queima dos combustíveis pode ser convertido em energia elétrica como assim através do calor a água líquida transforma-se em vapor d'água e este vapor pode movimentar uma turbina pela movimentação da turbina nós temos a produção de energia elétrica o problema que a eficiência desse processo é bem pequena nós temos ali cerca de quarenta por cento do calor sendo convertido em energia elétrica o resto vai ser liberado da forma de calor Será que existe uma maneira mais eficiente de converter a energia contida nos combustíveis diretamente em energia elétrica sem precisar fazer a condução
nós temos aqui as Tais células de combustível que podem ser chamadas também de pilhas de combustível o que esses equipamentos fazem é transformar converter continuamente a energia química contida nos combustíveis especificamente nas ligações dos combustíveis em energia elétrica sem precisar aí fazer o processo de combustão Na verdade o que a gente vai fazer em uma célula ou pilha de combustível é utilizar um processo que seria de combustão para então aí passar diretamente a energia contida nos combustíveis para energia elétrica e Teoricamente eficiência é bem maior Aqui nós temos a figura da espaçonave Gemini que utilizou
justamente uma célula de combustível uma pilha de combustível a lembrando esse termo pilha aqui já nos remete a uma reação redox que é totalmente espontânea então de maneira espontânea nós vamos converter a energia química contida nos Combustíveis e energia elétrica uma das células que é mais utilizadas E aí mais estudada que foi justamente utilizado aqui na GM é a célula de hidrogênio Muitas vezes os examinadores aí nas questões colocam apenas célula de hidrogênio Mas saiba que hidrogênio e oxigênio que vão ser utilizados nesse processo tá o hidrogênio é um gás combustível então nós podemos através
da reação do hidrogênio com oxigênio aí converter energia química em energia elétrica além de ser continuar aqui interessante que a gente Norte que a medida que você vai injetando os gases na célula de combustível a energia vai ser transformada convertida em uma na outra numa pilha normal à medida que acaba o eletrodo cá todo o ano de especificamente o Ando a pilhas essa aqui enquanto tiver gás sendo digitado na célula de combustível nós temos a transformação então e produção de energia elétrica Beleza dá uma olhadinha aqui na reação que nós temos então do processo de
combustão como se fosse a combustão do gás hidrogênio lembre-se que o hidrogênio pega fogo é então a ideia a gente utilizar um processo e como se fosse a combustão só que ao invés de a gente gerar energia aí térmica irá calor e o calor então transforma a água em vapor e o vapor então movimenta uma turbina A ideia é pegar já diretamente a energia contida aqui nos reagentes então transformar energia elétrica presa bora ver se esse processo é um processo redox então o hidrogênio aqui tem número de oxidação zero e também o oxigênio tendo 10
isso porque nós temos substância simples é que não reagente em relação a água o oxigênio inox - 2 e o hidrogênio tem número de oxidação aqui mais beleza Norte que nós estamos então observando que o hidrogênio vai aumentar o seu estado de oxidação e se aumenta o estado de oxidação nós temos um processo aqui de oxidação e quem oxida da os seus elétrons enquanto nós observamos oxigênio mais de 10 primeiros dois tão que temos um processo de redução e que reduz recebe elétrons do note essa reação que poderia ser utilizada para ser a combustão né
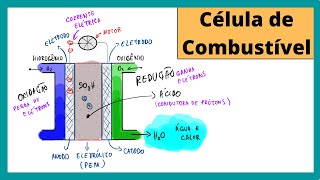
para liberar energia na forma de calor ela pode ser também aproveitada para a geração de corrente elétrica porque nós temos oxidação e redução aqui no processo que oxida da os elétrons para quem vai sofrer a redução eu pegar esses elétrons Vitor passa por um fio o fluxo ordenado dos elétrons através de um fio é conhecido como corrente elétrica beleza e como é que então nós temos uma célula de combustível figura de uma célula de combustível a primeira dos casos das questões a figura que os examinadores demonstram é parecido com isso aqui é verdade foi justamente
o perdão as questões aí de vestibulares Beleza o que vai acontecer então é que através dessas extremidades aqui os gases Eles serão injetados a injeção dependendo aí do desenho que você tiver na questão enfim do livro pode ser feita por cima ou por baixo aqui independe a eu vou colocar desse lado aqui a esquerda e o gás hidrogênio e aqui a direita nós vamos adicionar o injetar o gás oxigênio beleza aqui em baixo nós vamos ter a saída do hidrogênio que não foi consumido na reação Então como a conversão aqui não é de 100 porcento
o hidrogênio ele vai entrar e aí uma parte vai ser consumido do processo outra parte vai sair como o senhor se o excesso Mas para não perder o hidrogênio que a cara de ser produzido eles vão recircular aqui o hidrogênio bom então para dentro da célula Tá e aqui desse outro lado nós vamos ter o produto da reação lembra-la que a reação ele produzia a com produto h2oh então nós temos de um lado a injeção do gás hidrogênio outro lado oxigênio e a sair daqui de moléculas de água Beleza então desse lado aqui nós vamos
ter a saída de H 2 ohms interessante chefe a gente já fez as reações né já fez a reação ali como se fosse uma combustão e não é uma condição a gente vai equacionar as for hidrogênio hidrogênio + oxigênio sai água se fosse metano metano oxigênio sai CO2 + água equaciona como se fosse um processo de oxidação de combustão normal né a gente retirou nox de cada uma das espécies identifica quem oxidor que reduziu porque se a gente sabe quem é oxida e quem reduz nós sabemos Também quem é o compatimento anódico e catódico respectivamente
vou te mostrar isso só nós temos aqui então na nossa reação ele saiba que o oxigênio que o oxigênio para se ele tá sofrendo processo bom então eu Cá tudo de uma sala de combustível e o hidrogênio tá sofrendo um processo de oxidação então ele vai entrar no chamado compartimento anódico né então sério a pelo nosso desenho eu posso falar que aqui essa região onde o hidrogênio tá entrando por ser o hidrogênio que vai sofrer o processo de oxidação Akira chamado de ânodo dessa célula de combustível e aqui do outro lado por ser o oxigênio
que na equação a gente viu sofrer no processo de redução ele vai ser chamado de cátodo ou tá tudo beleza muito bem que mais que a gente tem nessa sala de combustível de interessante essas barras aqui escuras eles estão representando os eletrodos mas é um eletrodo chamado de eletrodo de suporte ele vai reagir não na verdade colocar eletrodo de suporte na verdade ele vai deixar que a reação ocorra nas suas superfícies o que ele tem mesmo é o catalisador que consegue acelerar o processo de quebra das ligações aqui dos nossos combustíveis é ele mesmo não
vai sofrer nenhum tipo de reação redox ou seja esse eletrodo vai continuar bem como esse Impacto e não vai sofrer corrosão demissão e nem aumento de massa como nós vimos nas pilhas aí clássicas digamos assim isso aqui é um eletrodo de suporte a reação só vai acontecer na sua superfície Beleza Aqui externamente nós temos o circuito externo formado por um fio essa pai parte aqui é um motor é um motor elétrico então ele vai ser movimentada aqui pela passagem de elétrons e aqui no meio do caminho nessa região é entre os nossos dois eletrodos de
suporte nós temos um eletrólito Na o eletrólito é uma substância que torna o meio condutor consequentemente aqui no meio nós vamos ter íons a desses eletrólitos aqui possui íons lembra que para o meio ser condutor do ponto de vista da química nós temos que ter Búzios ou ver como é que funciona então essa nossa sala de combustível claro que tudo vai acontecer ao mesmo tempo só que a pagar mesmo tempo a gente vai começar aqui pelo hidrogênio e depois fui olhar lá para o oxigênio beleza Começando aqui pelo hidrogênio na molécula vai saindo adicionada então
nós temos aqui H2 certo que faz apenas uma única ligação vai chegar na superfície do eletrodo e o eletrodo através do catalisador que possui na superfície vai quebrar a ligação tão quebra ligação aqui de hidrogênio separando os seus atos ao mesmo tempo os hidrogênios começam a sofrer a oxidação Queen oxida da elétrons então ele se transformam em íons h + e os elétrons aqui vão partindo pelo eletrodo em direção aqui ao circuito externo né então passa aqui para o circuito Ester esses elétrons vão movimentar Esse motor elétrico e depois seguiu seu caminho tá chegando aqui
até na região catódica beleza é claro que então vamos deixar aqui os elétrons chegando esses íons H + né eles vão começar a te e aqui para o outro lado através do nosso eletrólito é por isso que entre os nossos eletrodos eu preciso ter um eletrólito para que os rios consigam caminhar então o yoga mais tá chegando aqui tá se movimentando lá para o outro lado beleza legal os elétrons chegaram ao mesmo tempo a gente está adicionando o oxigênio lembra oxigênio faz uma dupla ligação entre os átomos ali da família seis a isso aqui é
o medida que ele vai encostando aqui no eletrodo por conta do catalisador ele aí quebra a ligação Então eu tenho um átomo de oxigênio separado do outro átomo de oxigênio colocar esse aqui maior Zinho que ficou bem pequeno né tudo bem olá pronto beleza aí o elétron vai chegando aqui oi beleza chegou encontrou os átomos de oxigênio e que acontece cada átomo de oxigênio desse captura dois elétrons transformando-se em ó 2 - que ao ânion alcóxido então percebo cheguei lá na superfície do catalisador eletrocatalisadores molécula de oxigênio todo mundo se juntou quebrou liga e a
oxigênio pegou dois elétrons transformando-se em ó 2 - ao mesmo tempo os íons H + estão chegando aqui né então cada oxigênio 2 - vai capturar vai se ligar a dois íons H + transformando-se em águinha h2obras né então chegou o oxigênio quebrou a ligação juntou-se com um elétron transformando o senhor 2 - os elétrons Aliás o 1 a 2 - junta aos íons H + transformando-se em água e aí nós temos a formação aqui do nosso produto que sai dessa região beleza isso vai sempre acontecendo em fluxo EA produção de energia elétrica de maneira
contínua injetor gás hidrogênio gás oxigênio continuar a mesma coisa hidrogênio chega bate quebra na estrutura aqui do nosso eletrodo os elétrons passem por dentro do movimentam aqui o nosso motor beleza e uns h mais Então vão pelo eletrólito lugar de Eu lembro que na solução e toque a gente pensa como se e são a passo aí para os seus h mais lugar de elétrons no fio elétron junto com o oxigênio quebra e a molécula transformando em um óxido 2h mais com dois aqui com o 2 - transforma-se em água e aí nós temos a movimentação
desse motor através desse processo né Muito mais eficiente segunda e os químicos e os engenheiros porque eu não tenho tanta liberação tem também com a liberação de calor mas não tanto quanto nós temos um processo é de combustão beleza gente for olhar com mais calma nós temos aqui as semi reações que acontecem lá no anodo e nunca todo então no ano nós fomos Verão os os hidrogênios da forma de H2 entrando quebra na superfície eletrodo transforma-se h mais o elétron vai pelo circuito interno não elétron segue pelo circuito interno e vem para que oxigênio cometi
viu pega esses íons H + então o yoga mais passou lá pelo nosso eletrólito e do mundo transformando-se em água e a reação global que a gente tem aqui H2 + O2 transformando em h2au e vai ser balança o diferente agora a equação que você tinha mostrado anteriormente estava para meio mal é balanceamento só foi diferente mas a proporção estequiométrica continuar sendo a mesma entre aí os nossos componentes né E agora como é que será que faz essas reações aqui nessa reação catódica e anódica dessa maneira se você entendeu Como funciona o processo aí da
célula de combustível entendeu que essas reações né porque poderiam ser combustões podem ser utilizados para converter diretamente energia química em energia elétrica através dessas células de combustível e são reações redox totalmente espontâneas na próxima aula eu te mostro como é que a gente pode fazer essas equações essa semi-reações através do método de balanceamento conhecido como íon-elétron eu te espero lá então até mais é
Related Videos

11:39
Balanceamento Íon-Elétron | Passo a Passo ...
Professor Igor Química
23,525 views

9:38
How does a HYDROGEN car WORK? The Secret o...
Engenharia Detalhada
63,765 views

13:42
Eletrólise | Conceitos Gerais | Eletroquímica
Professor Igor Química
28,802 views

12:31
How to make your OWN FUEL #Decarbonization...
Manual do Mundo
1,769,751 views
3:20
Célula de Combustível | Princípio de funci...
O Físico
23,975 views

8:58
HYDROGEN the fuel of the FUTURE. Hydrogen ...
Engenharia Detalhada
328,831 views

10:25
METAL DE SACRIFÍCIO | ÂNODO DE SACRIFÍCIO ...
Professor Igor Química
29,686 views

14:48
Eletrólise Ígnea | Eletroquímica
Professor Igor Química
19,135 views

10:55
CAR powered by HYDROGEN: we boost it!
Manual do Mundo
730,825 views

9:16
Eletrólise Aquosa | Conceitos Gerais | Ele...
Professor Igor Química
19,250 views

15:20
Fizemos BIODIESEL e COLOCAMOS NO CARRO! #B...
Manual do Mundo
1,537,381 views

16:37
ÓLEO DE COZINHA como combustível no avião ...
Aviões e Músicas
62,655 views

17:52
Toyota Mirai, carros elétricos ou a hidrog...
Star Motors Rio
18,556 views

10:40
LEIS DE FARADAY | ESTEQUIOMETRIA DA ELETRÓ...
Professor Igor Química
23,457 views

9:37
Eletrólise Aquosa | Eletrólise da Água| De...
Professor Igor Química
10,183 views

10:09
PRODUZINDO HIDROGÊNIO VERDE NA PRÁTICA
O Físico
134,299 views

4:17
Células de combustíveis
Evolucional
2,118 views

7:50
Proteção de Metais | Recobrimento de Metai...
Professor Igor Química
19,832 views

15:28
Eletrorefinamento | Eletrólise com Eletrod...
Professor Igor Química
6,860 views

4:55
COMO FUNCIONAM AS PILHAS E AS BATERIAS (EL...
Curso Enem Gratuito
137,072 views