ELETROQUÍMICA | QUER QUE DESENHE | MAPA MENTAL
144.34k views1552 WordsCopy TextShare
Descomplica
BAIXE O MAPA MENTAL EM ALTA RESOLUÇÃO: http://bit.ly/3YgaInf
---
VEM FALAR DE ELETROQUÍMICA!
No ví...
Video Transcript:
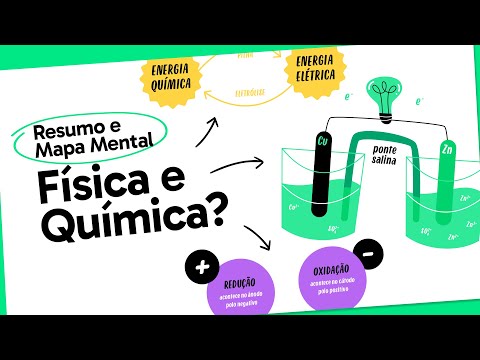
[Música] Fala galera descomplica tudo certinho com vocês eu sou o Diego Gomes monitor de química da descomplica e esse quer que desenho traz um resumo sobre eletroquímica esse assunto é muito recorrente nos vestibulares e é um assunto que está muito presente em nosso dia a dia deixei o mapa mental do vídeo completo para download aqui no link da descrição e vamos lá agora vamos desenhar Quando você pensa em eletroquímica Quais são as primeiras coisas que passam pela sua cabeça dividindo essa palavra em duas partes Eletro e química eu penso logo em eletricidade elétron ou algo
parecido Já a palavra química me faz lembrar de reações químicas transformações químicas e o significado de eletroquímica vai seguir por essa ideia mesmo onde o nosso estudo será direcionado para reações químicas e correntes elétricas se nós fôssemos dar uma definição para essa parte de nossos estudos nós diríamos o seguinte eletroquímica é o ramo da química que estuda o fenômeno da transferência de elétrons para transformar a energia química em energia elétrica ou energia elétrica em energia química lembre-se que essa transferência de elétrons irá ocorrer por meio de reações de oxirredução pela definição Já podemos imaginar que
iremos falar basicamente dois processos um irá transformar a energia química em energia elétrica e o outro será o caminho inverso Onde a energia elétrica será convertida em energia química o primeiro processo será conhecido como pilha este acontece de maneira espontânea basta você montar o equipamento que as reações começam a correr e a energia elétrica é produzida dizemos que este é um processo espontâneo provavelmente próximo a você tem um celular talvez você esteja Assistindo este vídeo nele e dentro de seu celular nós temos uma bateria e nela estão ocorrendo reações químicas e espontâneas que geram energia
elétrica para que ele esteja funcionando o outro processo é inverso pensa quando seu celular descarrega você precisa de uma corrente externa para que o processo conhecido como eletrólise ocorra Este é um processo não espontâneo para que ele ocorra você precisa força-lo com uma energia elétrica a energia elétrica será convertida em energia química vamos falar um pouco mais agora sobre esses dois processos começaremos pelas pilhas como essa transferência de elétrons acontece por meio de reações de oxirredução precisaremos de uma espécie química sofrendo oxidação e outra sofrendo redução Quem sofre redução irá receber elétrons e o seu
nox irá diminuir vamos pegar como exemplo a reação de redução do cobre o cátion cobre dois mais recebe dois elétrons indo a cobre sólido com nox Zero no produto essa semi-reação de redução irá ocorrer no catodo e na pilha será o nosso Polo positivo vamos usar o zinco como exemplo para sofrer oxidação o zinco sólido de Nox zero irá perder dois elétrons indo ao cátion zinco 2 + essa semi-reação de oxidação irá ocorrer sempre no ânodo e na pilha ele será o nosso polo negativo eu escolhi esses dois metais pois eles formam uma das pilhas
mais conhecidas a pilha de Daniel através do esquema dessa pilha podemos observar que o fluxo dos elétrons parte do ânodo para o cátodo e também que a Cuba onde ocorre a oxidação a massa do eletrodo de zinco diminui e a massa da Cuba em que temos o eletrodo de cobre a sua massa aumenta cada semi-reação irá apresentar um potencial que permitirá o cálculo da diferença de potencial ddp essa diferença de potencial poderá ser calculada da seguinte forma potencial padrão de redução mais potencial padrão de oxidação ou potencial de redução maior menos pote um padrão de
redução menor Fica tranquilo que esses valores de potencial padrão são obtidos experimentalmente portanto as questões vão fornecer eles veja na tabela como eles podem aparecer Esses são apenas alguns exemplos pegando exemplo visto anteriormente entre o zinco e o cobre o potencial padrão de redução do zinco é menos 0,76 volts e para o cobre mais 0,34 volts sendo assim o potencial pode explicar o motivo de o zinco sofrer oxidação e não o cobre isso acontece pelo fato de o cobre apresentar um potencial de redução maior do que o zinco então ele acaba reduzindo e o zinco
é obrigado a oxidar lembre-se que se você inverter a semi-reação de redução para oxidação ou vice-versa você precisa mudar o sinal também aplicando uma das fórmulas de calcular a ddp temos ddp igual a potencial padrão de oxidação mais potencial padrão de redução portanto + 0,76 + 0,34 é igual a mais 1,10 V perceba que o valor final foi positivo e sempre será assim uma pilha um processo espontâneo e a diferença de potencial sempre será positiva algo que às vezes passa muito rápido é a ponte Salina repare que ela está ali para fechar o circuito e
principalmente Balancear as cargas sem ela a pilha irá funcionar por um curto período na cuba onde ocorre a oxidação a quantidade de cátions aumenta sendo assim a ponte Salina que apresenta sais dissolvidos manda ânions para Balancear essas cargas por outro lado na cuba onde ocorre a redução a quantidade de cátions diminui então a ponte Salina manda cátions para compensar essa diminuição que esse assunto Está muito presente no co mano nós Já percebemos Mas você sabia que ele tem uma aplicação até mesmo Econômica através de metais de sacrifício nós conseguimos proteger diversos metais imagina ter que
reparar todo o casco de um navio por ter sofrido muita corrosão o metal de sacrifício será um metal que irá sofrer oxidação no lugar de outro para isso este deverá apresentar o maior potencial de oxidação do que o metal que você quer proteger podemos ver no casco do navio algumas chapas metálicas pequenas essas chapas irão sofrer oxidação no lugar do ferro que compõem o casco do navio nós vimos boa parte do conteúdo até aqui vamos para a segunda parte onde falaremos do processo inverso eletrólise muito do que nós vimos em pilha irá valer aqui teremos
algumas diferenças e eu vou mostrar para vocês teremos ainda um processo de oxirredução uma espécie sofrerá redução e a outra irá oxidar a redução continua ocorrendo no catodo e a oxidação no anudo porém agora o processo é não espontâneo a diferença de potencial será negativo e o ânodo será o Polo positivo e o cátodo o polo negativo mas não confunda o fluxo dos elétrons continua do anudo para o Kadu só que agora é do Polo positivo para o polo negativo vamos ter dois tipos de eletrólise ígnea ou aquosa a diferença está na presença ou ausência
de água a eletrólise ígnea ocorre na ausência de água sendo assim um material utilizado precisa ser aquecido até a fusão vamos pegar como exemplo a eletrólise ígnea do nacl o famoso sal de cozinha a primeira coisa será aquecer o nacl sólido até virar NSL líquido onde o cátion no estado líquido serão formados agora nós ire de buscar a descarga desses íons o n a mais sofre redução indo a na sólido e o CL menos sofre oxidação indo a cl2 gasoso já na eletrólise aquosa do nacl como nós temos a presença de água ela também pode
sofrer ionização portanto teremos uma competição entre os íons para saber quem irá sofrer essa descarga as reações que teremos serão dissolução do nacl formando na mais aquoso e CL menos aquoso auto-ionização da água formando h+ aquoso e o h menos aquoso podemos ver que temos dois cátions e dois ânions sendo assim a pergunta que faremos é quem sofre a descarga aqui para isso precisaremos analisar a ordem de prioridade para cada par para os cátions temos a seguinte ordem metais alcalinos metais alcalinos terrosos e a mais perdem para o h+ e este perde para os demais
cátions para os ânions temos a seguinte ordem oxigenados e f menos perdem para o h menos e este perde para os demais ânions portanto entre o h+ e o na+ Quem irá sofrer a descarga será o h+ já entre o h menos e o CL menos o CL menos irá sofrer a descarga teremos Então as seguintes semi-reações na semi-reação de redução teremos dois mol de cátion h+ aquoso recebendo dois elétrons e indo a dois mol de H2 gasoso no produto e nade oxidação teremos dois mols de CL menos gasoso perdendo dois elétrons e formando dois
mols de cl- gasoso e para terminarmos lembre-se que os dois processos tendo as duas semi-reações para cada um deles basta somá-las para chegarmos na equação global e a quantidade LED de elétrons que foi perdido durante a oxidação sempre deve ser igual a quantidade recebida na redução Deu para entender tudo sobre eletroquímica não é mesmo então deixa nos comentários quais os outros temas que você quer ver aqui não quer que desenhe aproveita se inscreve no canal ativo Sininho para não perder nenhuma notificação nenhuma novidade que nós lançamos aqui no canal E é claro que o conteúdo
completo com curso cronograma planejamento de estudos tá na descomplica e eu deixei um link na descrição para você assinar com super desconto ah e não esquece do mapa mental hein o link para baixar ele de graça e completo também está na descrição Falou galera tchau tchau até a próxima [Música]
Related Videos

26:42
ELETROQUÍMICA: PILHAS e BATERIAS | Química...
Química com Prof. Paulo Valim
175,441 views

11:25
O que é Termoquímica?| Química | Quer Que ...
Descomplica
419,881 views

4:55
COMO FUNCIONAM AS PILHAS E AS BATERIAS (EL...
Curso Enem Gratuito
97,931 views

5:44
TABELA PERIÓDICA: DEFINIÇÃO, NÚMEROS E PER...
Descomplica
3,135,585 views

15:30
ELETROQUÍMICA - PILHA
Professor Gabriel Cabral
700,405 views

6:23
QUÍMICA ORGÂNICA | Química | Quer Que Dese...
Descomplica
771,623 views

29:25
PILHAS II - UMA REVISÃO OBRIGATÓRIA
Café com química - Prof Michel
14,441 views

7:58
QUÍMICA ENEM: CINÉTICA QUÍMICA | QUER QUE ...
Descomplica
341,446 views

23:35
PILHA I - VAMOS APRENDER!!!! Potenciais d...
Café com química - Prof Michel
22,180 views

5:17
NOX | QUER QUE DESENHE | DESCOMPLICA
Descomplica
744,644 views

13:29
🧪 PILHA DE DANIELL: DEFINITIVO!
Professor Gabriel Cabral
190,104 views

13:04
ELETROQUÍMICA: pilha | Proenem
ProEnem - Enem 2024
12,800 views

4:38
MODELOS ATÔMICOS: Dalton, Thomson e Ruther...
Descomplica
3,179,984 views

10:52
HIDROCARBONETOS: TUDO PARA O ENEM E VESTIB...
Descomplica
154,410 views

13:05
PILHA DE DANIELL | PILHA COBRE ZINCO | ELE...
Professor Igor Química
66,661 views

14:21
ELETROQUÍMICA - Oxidação e Redução | Resum...
Curso Enem Gratuito
170,127 views

6:33
ISOMERIA PLANA, ESPACIAL, GEOMÉTRICA E ÓPT...
Descomplica
914,571 views

19:06
Calculus at a Fifth Grade Level
Lukey B. The Physics G
8,041,155 views